Links de passagem do livro para A2.3 T-SPOT.TB – step by step
O T-SPOT.TB tem várias etapas (4). Essas etapas são detalhadas a seguir e mostradas na Fig. A2.3.1 (preparação da amostra e procedimentos de teste) e na Fig. A2.3.2 (interpretação).
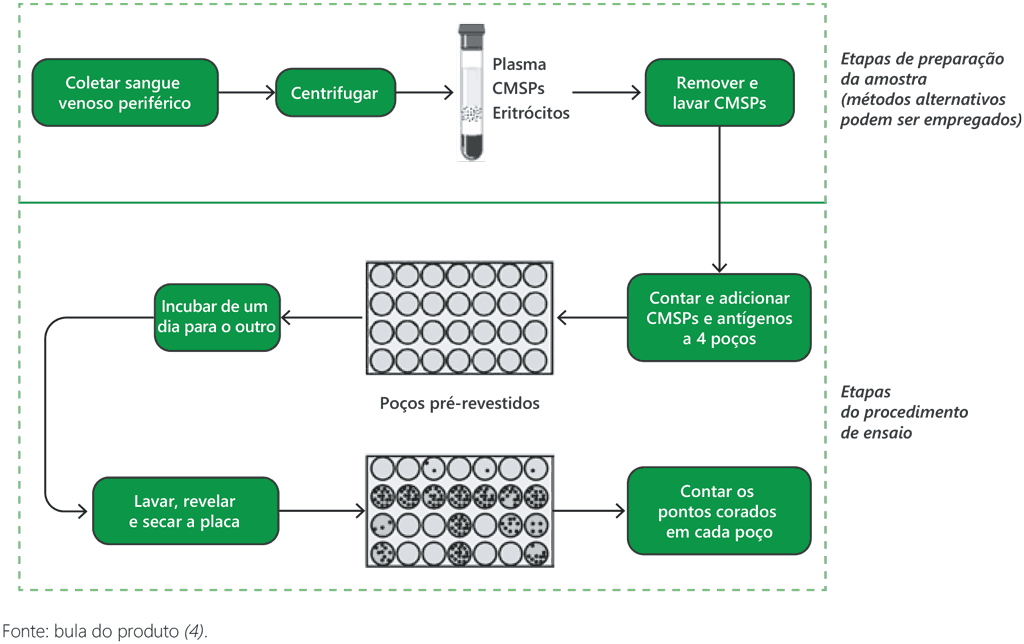
Etapa 1. Procedimentos de amostragem de sangue
Os procedimentos de coleta e preparação de amostras para o T-SPOT.TB são diferentes dos procedimentos para o QFT-Plus e o WANTAI TB-IGRA. Amostras de sangue total devem ser coletadas em tubos de coleta de sangue (por exemplo, tubos Vacutainer® CPT™ ou tubos de heparina de lítio), e os tubos devem ser agitados para permitir a mistura da heparina com o sangue. O sangue coletado deve ser armazenado em temperatura ambiente (18 a 25 °C), e não deve ser refrigerado nem congelado; são necessários cerca de 8 mL de sangue. Em seguida, são adicionados o tampão de trabalho e os anticorpos, que se ligarão aos linfócitos T (incubação por 15 minutos em temperatura ambiente). Em seguida, adiciona-se um reagente de esferas, que estimula a formação de imunocomplexos de esferas mediados por anticorpos (mais 15 minutos de incubação em temperatura ambiente).
Etapa 2. Separação de células mononucleares do sangue periférico
Glóbulos brancos ou células mononucleares do sangue periférico (CMSPs) devem ser separados. O procedimento de separação de CMSPs do sangue coletado é ligeiramente diferente para tubos de coleta de sangue CPT ou tubos de heparina de lítio (verifique as instruções do fabricante). Os métodos incluem centrifugação ou o uso de placas Ficoll®. Depois de separadas, as CMSPs são lavadas várias vezes, centrifugadas e ressuspendidas para eliminar todos os outros produtos (como gamaglobulinas) presentes normalmente no sangue humano e que podem interferir no teste. Em seguida, as CMSPs são contadas, pois são necessárias 250 mil células (± 50 mil) para cada poço das células de teste.
Etapa 3. Poço pré-revestido
Depois que as CMSPs tiverem sido separadas da amostra de sangue total, um número padrão de CMSPs é adicionado a quatro poços pré-revestidos fornecidos pelo fabricante: um Nil (controle negativo), um contendo fitohemaglutinina (controle positivo) e dois contendo antígenos específicos de M. tuberculosis. Não há necessidade de uma curva padrão para este teste.
Etapa 4. Incubação de um dia para o outro
O substrato do ensaio ImmunoSpot de imunoadsorção enzimática (ELISPOT, na sigla em inglês) é adicionado a cada poço, juntamente com 250 mil CMSPs. Esses poços são incubados a 37 °C; a incubadora precisa ter 5% de CO2 e umidificação.
Etapa 5. Lavagem, revelação e secagem da placa
Após a incubação, usa-se uma solução salina tamponada com fosfato (PBS, na sigla em inglês) para lavar a placa, que é descartada em seguida.
Essa lavagem deve ser repetida quatro vezes. Após a quarta lavagem, o reagente conjugado é adicionado e incubado por 1 hora. Em seguida, o conjugado é descartado e a lavagem quatro vezes com a solução PBS é repetida. Os substratos são adicionados e incubados durante 7 minutos e, em seguida, a lavagem com PBS é novamente repetida quatro vezes. Por fim, deixa-se a placa secar durante 4 horas a 37 °C ou 16 horas em temperatura ambiente.
Etapa 6. Contagem dos pontos e interpretação dos resultados do teste
Fig. A2.3.1. Fluxo de trabalho do T-SPOT.TB: procedimentos de preparação e testagem de amostras
Materiais fornecidos pelo fabricante
Os materiais fornecidos pelo fabricante incluem uma placa de microtitulação, o painel A (que compreende alvos antigênicos precocemente secretados de 6 kDa [ESAT-6]), o painel B (que compreende antígenos de proteína de filtrado de cultura de 10 kDa [CFP-10]) e um controle positivo (que contém fitohemaglutinina, reagente conjugado e solução de substrato). Esses componentes do kit devem ser armazenados entre 2 e 8 °C, e deve-se evitar a exposição prolongada da solução de substrato à luz.
Equipamentos de laboratório necessários
Os seguintes equipamentos de laboratório são necessários para o T-SPOT.TB:
- cabine de segurança biológica de classe 2 (recomendado para preparação de reagentes e amostras);
- cronômetro;
- equipamento para contagem das CMSPs (de preferência, um contador automatizado, como um analisador hematológico ou um contador de células exclusivo);
- incubadora umidificada capaz de manter uma temperatura de 37 ± 1 °C com 5% de CO2);
- lavadora de placas de microtitulação ou equipamento para lavagem manual das placas; e
- equipamento para leitura dos pontos nas placas (por exemplo, microscópio, microscópio digital, lupa ou imageador de placas).
Materiais necessários
Os seguintes materiais são necessários para o T-SPOT.TB:
- tubos de coleta de sangue (por exemplo, tubos Vacutainer CPT ou tubos de heparina de lítio);
- pipetas com ponteiras estéreis; e
- reagentes necessários para contagem das CMSPs.
Pessoal necessário
Inicialmente, é necessário um flebotomista capacitado para coletar e manipular as amostras de sangue. É necessário tempo de um técnico de laboratório para a preparação inicial (ou seja, para a separação e contagem das CMSPs e para a configuração dos poços); depois, é necessário tempo significativo de técnico após a incubação para a lavagem e a adição dos reagentes; por fim, é necessário tempo de técnico para a contagem dos pontos.
Capacitação, supervisão e controle de qualidade
O pessoal deve receber capacitação no procedimento do ensaio e precisa entender as instruções de uso antes de realizar o ensaio. A equipe precisa de monitoramento e avaliação contínuos para o CQ.
Precauções
Os técnicos de laboratório devem sempre usar trajes de proteção (incluindo jaleco de laboratório, luvas descartáveis e óculos de proteção) ao trabalhar com os reagentes químicos necessários para esse teste. O T-SPOT.TB destina-se apenas ao uso in vitro. A não observância das instruções do fabricante pode gerar resultados incorretos.
Interpretação do T-SPOT.TB
A Fig. A2.3.2 mostra o diagrama de fluxo do algoritmo de interpretação dos resultados do T-SPOT.TB.
Fig. A2.3.2. Diagrama de fluxo do algoritmo para a interpretação do T-SPOT.TB
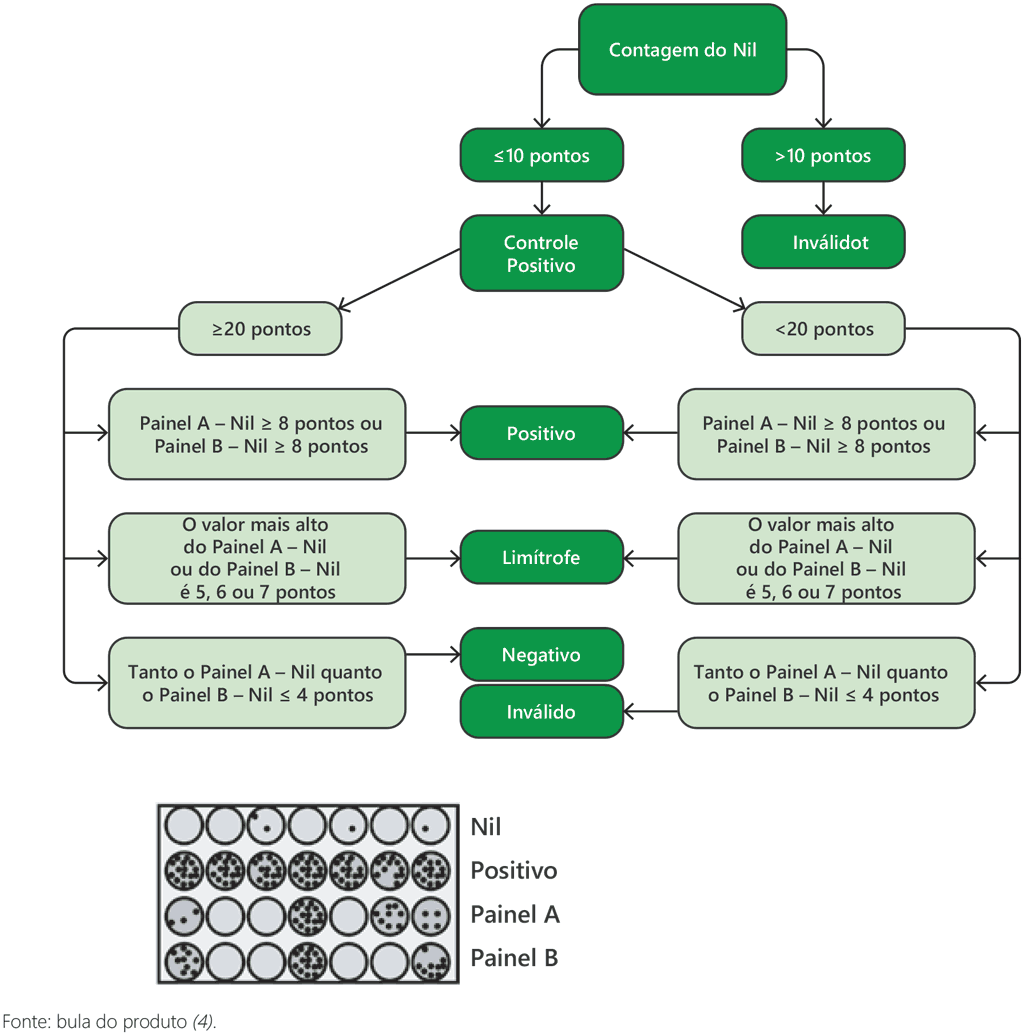
Os resultados do teste T-SPOT.TB são interpretados subtraindo-se a contagem de pontos no poço de controle Nil da contagem de pontos em cada um dos painéis, de acordo com o seguinte algoritmo, fornecido pelo fabricante (4):
- O resultado do teste é positivo se (Painel A – Nil) e/ou (Painel B – Nil) tiverem ≥ 8 pontos (Tabela A2.3.1, abaixo).
- O resultado do teste é negativo se tanto (Painel A – Nil) como (Painel B – Nil) tiverem ≤ 4 pontos (inclui valores iguais a zero) (Tabela A2.3.2, abaixo).
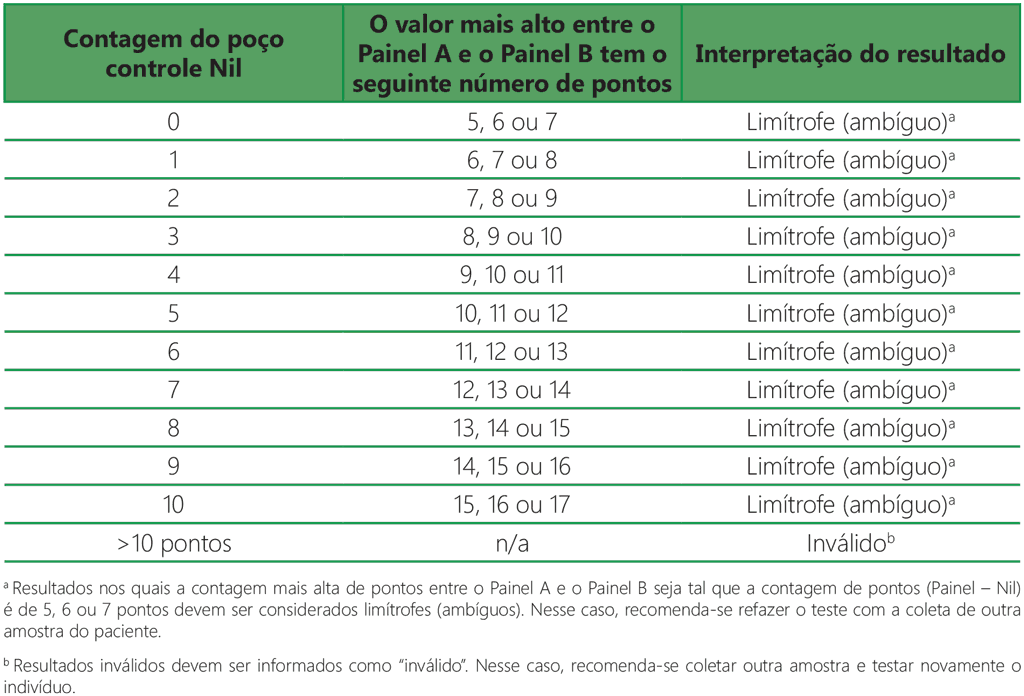
- O resultado do teste deve ser considerado limítrofe se a maior contagem de pontos do Painel A ou do Painel B for tal que a contagem de pontos (Painel menos Nil) seja de 5, 6 ou 7 pontos. Nesses casos, recomenda-se refazer o teste com a coleta de outra amostra do paciente (Tabela A2.3.3, abaixo).
- Se o resultado do teste continuar sendo limítrofe, outros testes diagnósticos ou informações epidemiológicas devem ser usados para ajudar a determinar a situação de TB infecção do paciente.
Os linfócitos T que liberam interferon-gama são contados pelo ensaio ELISPOT. O resultado do teste é apresentado como o número de linfócitos T produtores de interferon-gama (ou seja, células formadoras de pontos), e o resultado é classificado pelo fabricante como positivo, negativo ou limítrofe/ambíguo.
Tabela A2.3.1. Interpretação positiva do T-SPOT.TB: (Painel A – Nil) ou (Painel B – Nil) ≥ 8 pontos
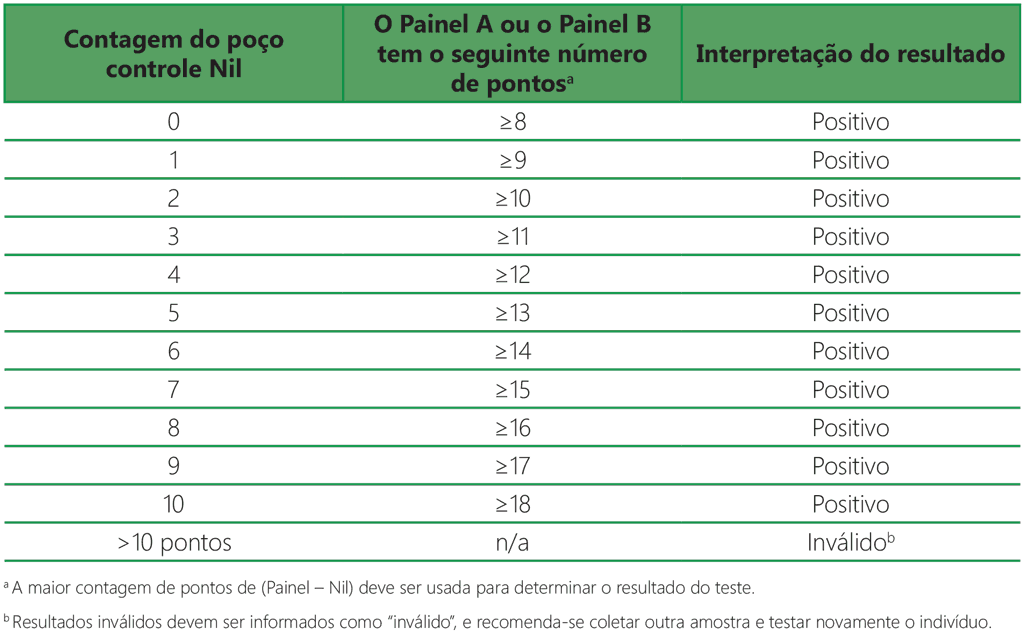
Tabela A2.3.2. Interpretação negativa: (Painel A – Nil) e (Painel B – Nil) ≤ 4 pontos
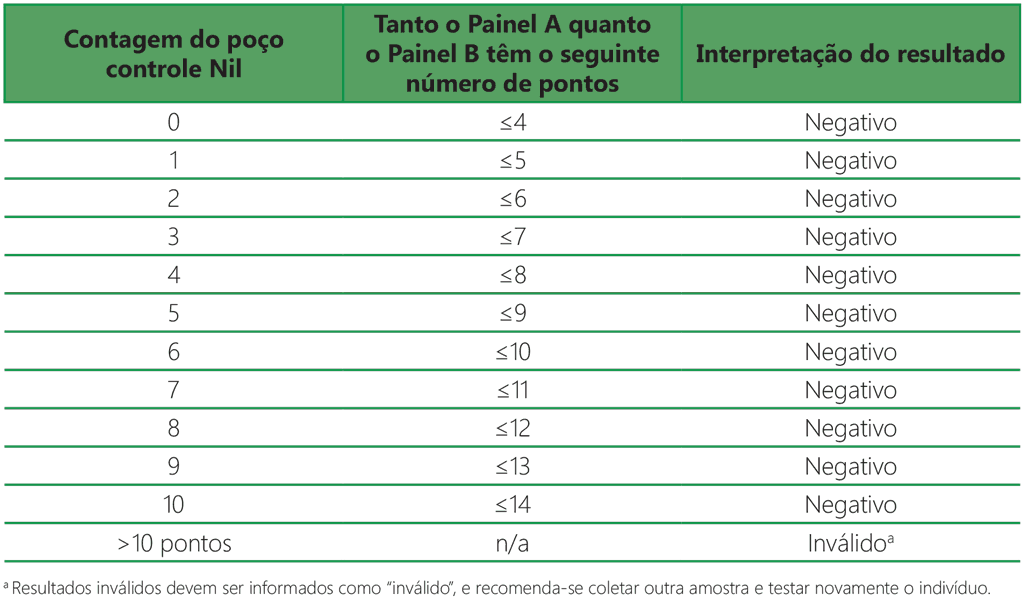
Tabela A2.3.3. Interpretação limítrofe (ambígua): o valor mais alto entre (Painel A – Nil) e (Painel B – Nil) é 5, 6 ou 7 pontos
 Opinião
Opinião