Book traversal links for 2.5.2 Consideraciones relativas a la precisión al escoger una prueba diagnóstica, 2.5.3 Pasos y procedimientos para implementar una nueva prueba diagnóstica
Los valores diagnósticos de una prueba varían en función de la prevalencia de la TB en la población de pacientes. En el cuadro 2.1 se presentan ejemplos de proyecciones a escala poblacional de los resultados de la utilización de diversas PDRm recomendadas por la OMS en entornos con prevalencia de TB diferente, a partir de las estimaciones de sensibilidad y especificidad combinadas que se extrajeron de las declaraciones normativas de la OMS para cada prueba. Al escoger una prueba para su implementación, es posible que los países tengan que encontrar soluciones de compromiso entre una sensibilidad mayor o menor y una especificidad mayor o menor, en función de la prevalencia de la TB en el país. Los resultados negativos falsos pueden dar lugar a oportunidades desaprovechadas de tratar la TB. Los resultados positivos falsos pueden conducir a tratar en exceso a pacientes sin TB. En algunos entornos, los países pueden necesitar una tarea adicional de modelización que respalde las estrategias de implementación, basada en las soluciones de compromiso entre la sensibilidad y la especificidad en sus entornos.
Cuadro 2.1 Características del rendimiento de las pruebas moleculares en la detección de la TB
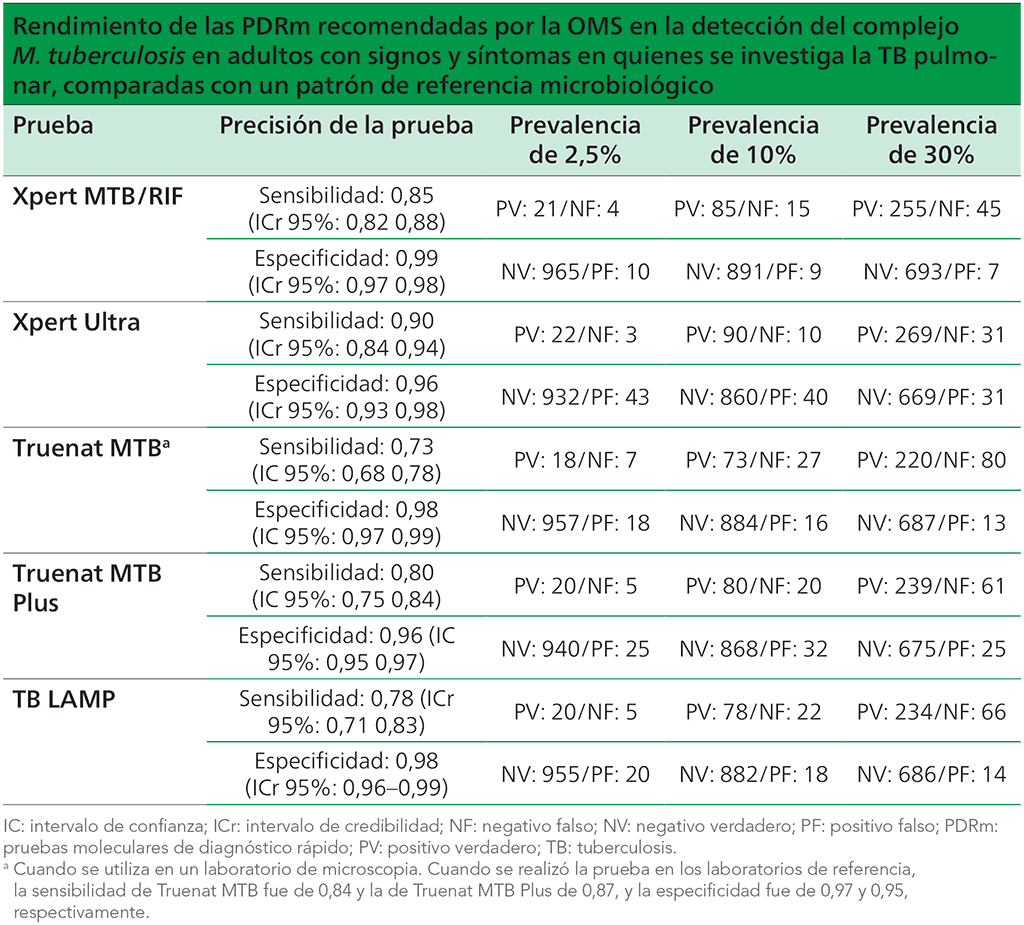
Los valores diagnósticos en el cuadro 2.1 suponen que la prueba indicada es la prueba diagnóstica inicial de la TB. Los países pueden decidir utilizar la radiografía de tórax con el fin de seleccionar quién debe someterse a un análisis molecular, para disminuir el número de personas examinadas y los costos asociados (19,20). Este método debe mejorar la probabilidad previa a la prueba de presentar TB y, con ello, mejorar el valor predictivo de las pruebas moleculares y disminuir los resultados positivos falsos, especialmente en los grupos poblacionales con una prevalencia baja de TB. Por ejemplo, se calculó que al agregar la radiografía de tórax como prueba de selección a un algoritmo, en el que todos los pacientes con signos y síntomas de TB reciben una prueba MTB Xpert/RIF, se aumenta el valor predictivo positivo de la prueba Xpert MTB/RIF de 69% a 82% en una población con una prevalencia de 1% (20).
Consideraciones epidemiológicas al seleccionar una prueba diagnóstica
Al seleccionar una prueba diagnóstica para su implementación, es importante considerar las características (es decir, los grupos de riesgo) de la población atendida. Estas características deben derivarse de estudios poblacionales, cuando haya alguno, incluida la proporción de casos de TB resistente a la RIF, la INH y la FQ; la proporción en las personas que son positivas al VIH; la proporción de casos extrapulmonares; y la proporción en la población infantil. La comprensión de la proporción de resistencia a un fármaco recién introducido (por ejemplo, la BDQ) es de gran importancia durante las etapas iniciales de utilización del fármaco, cuando la capacidad de tratamiento se puede ampliar más rápidamente que la capacidad de realizar PSF.
2.5.3 Pasos y procedimientos para implementar una nueva prueba diagnóstica

Como un paso inicial en la introducción de una nueva prueba diagnóstica, los países deberían examinar las políticas, las orientaciones y los informes de la OMS, además de todas las guías de implementación disponibles en la OMS, la Iniciativa Mundial de Laboratorios (GLI), la Fundación para la Obtención de Medios de Diagnóstico Innovadores (FIND) y los asociados en la implementación. Se debe prestar especial atención a las políticas y las recomendaciones de la OMS sobre la utilización de la prueba, sus limitaciones y la interpretación de los resultados. Los pasos clave al introducir una prueba nueva se indican en el recuadro 2.1. Los pasos iniciales primordiales incluyen definir el uso previsto de la prueba nueva, elaborar un plan de ejecución con estimación de costos, crear la infraestructura (instrumentos e instalaciones) y formar los recursos humanos requeridos para la realización de la prueba. En las siguientes secciones se organizan los pasos clave en diez áreas principales:
- Área 1. Políticas y planificación
- Área 2. Aspectos regulatorios
- Área 3. Equipamiento
- Área 4. Cadena de suministro
- Área 5. Procedimientos
- Área 6. Datos digitales
- Área 7. Garantía de la calidad
- Área 8. Registro y comunicación de resultados
- Área 9. Capacitación y evaluación de competencias
- Área 10. Seguimiento y evaluación
En esta sección se abordan los pasos en cada una de las áreas.
Área 1: Políticas y planificación
1.1 Conformar un grupo de trabajo técnico, y definir sus funciones y responsabilidades.
1.2 Examinar las políticas y las guías técnicas y de implementación de la OMS.
1.3 Definir las finalidades inmediatas y futuras de la prueba.
1.4 Actualizar los algoritmos de diagnóstico y las directrices nacionales.
1.5 Realizar un análisis de la situación, que incluya la bioseguridad.
1.6 Elaborar un plan operativo de implementación progresiva con estimación de costos.
Paso 1.1 Conformar un grupo de trabajo técnico y definir sus funciones y responsabilidades
Debe conformarse un grupo de trabajo técnico con representantes de todos los interesados directos clave para orientar el proceso de implementación de las nuevas pruebas y tecnologías diagnósticas. La conformación de este grupo debe ser dirigida por el Ministerio de Salud, el programa nacional de TB y el laboratorio nacional de referencia de TB. El grupo debe recibir el mandato de asesorar al Ministerio de Salud, el programa nacional de TB y el laboratorio nacional de referencia en la implementación de las pruebas, la elaboración de planes de acción, la supervisión de la implementación de la prueba y la evaluación del impacto y el éxito de la introducción de la prueba. Se puede invitar a participar a los representantes de los siguientes interesados directos clave:
- el Ministerio de Salud, el programa nacional de TB, los laboratorios nacionales de referencia de TB y los laboratorios regionales;
- los institutos de investigación u otras organizaciones con experiencia en la utilización de la nueva prueba diagnóstica;
- los asociados en la ejecución, incluidos los asociados fuera del sector de la TB;
- los laboratorios periféricos y los establecimientos clínicos que participarán en la realización de la prueba;
- los organismos regulatorios;
- los expertos en gestión de datos o tecnología de la información; y
- los sistemas de transporte de muestras para la realización centralizada o regional de la prueba (TB y no TB).
Este grupo debe estar dirigido por una persona debidamente calificada, por ejemplo, un funcionario del laboratorio nacional de TB o la persona de enlace con los laboratorios del programa nacional de TB o el laboratorio nacional de referencia. Un componente integral del proceso de planificación debe ser la definición de las funciones y las responsabilidades de los miembros del equipo de implementación, los asociados y los donantes externos.
Paso 1.2 Examinar las políticas y las guías técnicas y de implementación de la OMS disponibles
Los miembros del grupo de trabajo técnico deberían familiarizarse con el contenido tanto de las políticas, las directrices y los informes pertinentes de la OMS, como con toda guía de implementación disponible en la OMS, la GLI, FIND y los asociados en la implementación. Se debe prestar especial atención a las políticas y las recomendaciones de la OMS sobre la utilización de la prueba como ayuda al diagnóstico de la TB o la detección de farmacorresistencia, las limitaciones de la prueba y la interpretación de sus resultados.
Paso 1.3 Definir las finalidades inmediatas y futuras de la prueba
Los programas deben definir con claridad la finalidad, el alcance y la utilización prevista de la nueva prueba diagnóstica, puesto que esto influirá en muchos aspectos del plan de implementación. Por ejemplo, el sistema o la red de laboratorios necesarios para proporcionar resultados oportunos a fin de tomar las decisiones de atención al paciente es muy diferente del sistema que se necesita para realizar un estudio anual sobre la farmacorresistencia.
Paso 1.4 Actualizar los algoritmos de diagnóstico y las directrices nacionales
El grupo de trabajo técnico debería examinar los algoritmos nacionales de diagnóstico existentes, teniendo presente el uso previsto de la nueva prueba diagnóstica, las características epidemiológicas del país, los algoritmos de pruebas vigentes, los sistemas de derivación de muestras existentes y otras consideraciones operativas, y formular recomendaciones al Ministerio de Salud y al programa nacional de TB. En la sección 3 se describen en detalle los algoritmos modelo de uso de las pruebas recomendadas por la OMS.
El grupo de trabajo técnico también debería examinar las directrices sobre el uso de los resultados de las nuevas pruebas diagnósticas en las decisiones de atención al paciente. Las directrices clínicas deberían proporcionar al personal médico y de enfermería y a los profesionales de salud orientaciones claras sobre el uso previsto de la nueva prueba diagnóstica, describir los grupos de pacientes destinatarios, y explicar cómo solicitar la prueba y cómo interpretar, aplicar y comunicar sus resultados.
Paso 1.5 Realizar un análisis de la situación, que incluya la bioseguridad
Con el propósito de fundamentar los planes de ejecución de la nueva prueba diagnóstica, debe realizarse un análisis de la situación de la red de laboratorios y las capacidades existentes. Para la mayoría de las pruebas, los elementos clave que deben evaluarse incluyen los requisitos regulatorios; la infraestructura de los laboratorios y de la red; el sistema de transporte de muestras existente; las aptitudes, los conocimientos especializados y la experiencia del personal; las capacidades en cuanto a las tecnologías de la información; la conectividad que se emplea para el diagnóstico; la disponibilidad y adecuación de los POE; la cadena de suministro; los recursos económicos; y los sistemas de garantía de la calidad. La evaluación también debería determinar las necesidades de revisión de los formularios y las herramientas de capacitación, registro y presentación de informes para el seguimiento y la evaluación. Con respecto a los posibles centros de pruebas, será necesario realizar evaluaciones completas de la preparación del laboratorio con respecto a las instalaciones, la dotación de personal y la infraestructura. Dado que la infección por TB adquirida en el laboratorio es un riesgo reconocido para los técnicos de laboratorio, es fundamental emprender una evaluación de riesgos de la realización de la prueba nueva en el centro previsto, de manera que se cumplan al menos los requisitos mínimos de bioseguridad antes de implementar la prueba nueva (21). En el análisis de la situación tendrán que evaluarse también los segmentos pertinentes de la red de diagnóstico de la TB. El sistema de derivación de muestras es de especial importancia. En la publicación correspondiente de la GLI puede consultarse una lista de verificación para evaluar un sistema de derivación de muestras (17).
Paso 1.6 Elaborar un plan operativo de implementación progresiva con estimación de costos
La última etapa en esta área consiste en elaborar un plan de acción detallado para la implementación progresiva, con costos y prioridades, metas y un cronograma. A menudo, la implementación de una prueba nueva tiene que superar algunos obstáculos como el costo de los instrumentos, el equipo auxiliar y los materiales fungibles; requisitos para mejorar o crear la infraestructura necesaria de laboratorio y de la red (por ejemplo, un sistema de transporte de muestras); la necesidad de personal especializado, competente y bien capacitado; la necesidad de asistencia técnica de expertos; el mantenimiento del carácter confidencial de la información del paciente; y la organización de un sistema de garantía de la calidad. El éxito en la ejecución del plan exigirá compromisos en materia de recursos económicos y humanos por parte del Ministerio de Salud o el programa nacional de TB, con el apoyo eventual de los asociados en la implementación. Se debería elaborar un presupuesto que aborde las actividades en colaboración con los principales asociados. En el anexo 1 se resumen los aspectos relacionados con el presupuesto.
Área 2: Aspectos regulatorios
2.1 Determinar los requisitos de importación.
2.2 Realizar un estudio de verificación en el país, según sea necesario.
2.3 Cumplimentar los procedimientos regulatorios nacionales.
Paso 2.1 Determinar los requisitos de importación
Es necesario consultar a las autoridades nacionales con el fin de determinar los procedimientos que deben seguirse en relación con la importación. Los países deben trabajar en estrecha colaboración con los fabricantes y los servicios técnicos autorizados de equipos y materiales fungibles a fin de determinar los requisitos de importación y registro e iniciar las verificaciones del caso en el país.
Paso 2.2 Realizar un estudio de verificación en el país, según sea necesario
Los estudios de validación⁷ son estudios en gran escala que se realizan con el fin de definir las características de rendimiento (por ejemplo, sensibilidad, especificidad, precisión, valor predictivo de un resultado positivo o negativo, robustez, fiabilidad y reproducibilidad) y evaluar las limitaciones y los criterios de aceptación de los resultados de una prueba. Los estudios de validación son una parte esencial del proceso de examen y formulación de recomendaciones de la OMS para la utilización de una prueba nueva. Una vez que se han publicado los estudios de validación en gran escala y se han definido las características del desempeño previsto de una prueba, los laboratorios que están implementando el método no necesitan repetir estos estudios en gran escala. En su lugar, estos laboratorios deben realizar los estudios de verificación en pequeña escala (22) con el fin de demostrar que el laboratorio puede lograr las mismas características de desempeño que se obtuvieron durante los estudios de validación, cuando la prueba se utiliza según se describe en estos estudios, y que el método es apropiado para el uso previsto en la población de pacientes destinatarios. Los países tienen que determinar sus propias necesidades de verificación, según las directrices nacionales y los requisitos de acreditación.
Paso 2.3 Cumplimentar los procedimientos regulatorios nacionales
Los países deben trabajar en colaboración estrecha con las autoridades competentes del gobierno, los fabricantes y los servicios técnicos autorizados con el objeto de cumplir los requisitos de la autoridad regulatoria nacional. Es necesario acordar un período adecuado para presentar la solicitud y proporcionar toda la evidencia científica complementaria que sea necesaria.
Área 3: Equipamiento
3.1 Escoger, adquirir, instalar y poner en marcha el equipamiento
3.2 Verificar y dar mantenimiento a los instrumentos
3.3 Evaluar la preparación del centro de pruebas y garantizar que sea seguro y funcional
Paso 3.1 Escoger, adquirir, instalar y poner en marcha el equipamiento
Un paso esencial del proceso de ejecución es seleccionar los instrumentos apropiados, que correspondan a las necesidades del laboratorio clínico o microbiológico y a los requisitos para realizar la nueva prueba diagnóstica. El instrumento más apropiado para un país dependerá del uso previsto de la prueba diagnóstica. En general, es importante escoger un instrumento que esté ampliamente disponible y cuente con distribución de suministros y apoyo local adecuados.
A fin de que los servicios de pruebas sean costo-eficientes, una prioridad debería ser considerar la integración de las pruebas de TB en las plataformas existentes, en los lugares donde es factible llevar a cabo análisis integrados (14). En los entornos donde los servicios de diagnóstico de la TB son independientes y tienen un gran volumen de trabajo con las pruebas de la TB, se pueden preferir los instrumentos exclusivos.
Sea cual fuere el instrumento escogido, la mayoría necesitará una asistencia calificada para su configuración, prestada por los ingenieros del fabricante que realizan la instalación. Entre los posibles aspectos complejos de la instalación está el suministro de energía y las opciones de energía de reserva, las conexiones eléctricas, las condiciones ambientales del laboratorio (por ejemplo, la temperatura máxima), de bioseguridad y ventilación, los equipos y programas informáticos, un plan de mantenimiento (por ejemplo, controles semanales, mensuales o inmediatamente antes de realizar la prueba), la garantía del equipo y la capacitación necesaria.
Paso 3.2 Verificar y dar mantenimiento a los instrumentos
Es necesario documentar que todos los documentos sean “adecuados para su propósito”, mediante una verificación con materiales conocidos positivos y negativos antes de comenzar a examinar las muestras clínicas. La verificación de los instrumentos tiene lugar en el momento de la instalación, después del servicio o la calibración, o después de haber desplazado los instrumentos.
Muchas pruebas dependen de instrumentos de precisión que exigen un mantenimiento preventivo periódico, y servicio y mantenimiento específicos. El usuario final debe realizar el mantenimiento preventivo periódico, con el fin de garantizar el buen rendimiento del instrumento. Los servicios técnicos autorizados deben llevar a cabo el mantenimiento, previa solicitud, según sea necesario. Los países deberían aprovechar todos los contratos disponibles de ampliación de garantía y servicios con el objeto de garantizar el funcionamiento continuo de los instrumentos.
Paso 3.3 Evaluar la preparación del centro de pruebas y garantizar que sea seguro y funcional
El programa nacional de TB o el laboratorio nacional de referencia suelen determinar los centros que realizarán las pruebas diagnósticas, en función de criterios como las características epidemiológicas de la TB, aspectos geográficos, el volumen de pruebas, la disponibilidad de personal capacitado, la eficiencia de las redes de derivación y el acceso de los pacientes a los servicios. Es importante evaluar en cada centro de pruebas su preparación utilizando una lista de verificación normalizada antes de que el centro comience a hacer pruebas en las muestras clínicas. Además, se debe evaluar periódicamente la seguridad y la funcionalidad operativa de los centros existentes.
En un centro de pruebas funcional los instrumentos para realizar las pruebas deben estar colocados de manera apropiada en un lugar limpio, seguro y adecuado. La mayoría de los equipos necesita un suministro eléctrico ininterrumpido y condiciones adecuadas de funcionamiento y almacenamiento (es decir, con regulación de la humedad y la temperatura). Un entorno seguro debe cumplir las recomendaciones de bioseguridad de la OMS para la realización de las pruebas diagnósticas, en instalaciones con contención y ventilación adecuadas; también requiere la utilización de equipos de protección personal adecuados y la eliminación segura de los desechos biológicos, en conformidad con las regulaciones. Si el entorno de trabajo no es funcional y presenta riesgos, se puede alterar la calidad y la fiabilidad de las pruebas.
Área 4: Cadena de suministro
4.1 Examinar los procedimientos de previsión, pedido y distribución.
4.2 Establecer procedimientos de monitoreo de la calidad de los reactivos y su fecha de caducidad.
Paso 4.1 Examinar los procedimientos de previsión, pedido y distribución
La disponibilidad ininterrumpida de reactivos y material desechable en el centro de pruebas es esencial para fortalecer la capacidad técnica en las primeras etapas de implementación (evitando retrasos prolongados entre la capacitación y la disponibilidad de reactivos y materiales desechables) y garantizar un servicio homogéneo durante el uso de rutina. Las siguientes medidas serán necesarias con el fin de garantizar el suministro ininterrumpido de reactivos y materiales desechables:
- Procurar que el personal de laboratorio capacitado contribuya a la definición de las especificaciones de los reactivos, los bienes fungibles y los equipos.
- Agilizar los procedimientos de importación y distribución en el país, de manera que el período de validez de los reactivos y los materiales fungibles sea suficiente, una vez que llegan a los centros de pruebas.
- Supervisar con cuidado los índices de consumo, vigilar los períodos máximos de validez específicos de los reactivos y definir las previsiones con el fin de evitar los límites de caducidad o los desabastecimientos.
- Planificar cuidadosamente para que los centros hayan recibido la capacitación y se hayan instalado los equipos, antes del envío de los reactivos.
- Supervisar de manera continua todas las etapas de la compra y la cadena de suministro, con el fin de limitar al mínimo los retrasos y de que los centros reciban los reactivos correctos de conformidad con el cronograma planificado.
Las estrategias de compras y distribución se deben reevaluar con intervalos periódicos, con el fin de que respondan a las necesidades y la situación actual.
Paso 4.2 Elaborar los procedimientos de monitoreo de la calidad de los reactivos y su fecha de caducidad
Cuando se diseña el sistema de compras y distribución es indispensable tener en cuenta la fecha de caducidad de los reactivos y sus condiciones de almacenamiento. Los gerentes de laboratorio deberían supervisar de manera sistemática la calidad de los reactivos y su fecha de caducidad a fin de garantizar que se obtengan resultados de buena calidad de las pruebas. Además, el laboratorio tiene que definir los procedimientos normalizados de trabajo sobre la manipulación de los reactivos y los productos químicos usados, para velar tanto por la calidad como por la seguridad.
El control de los lotes nuevos, también conocido como verificación entre lotes, debe realizarse con los lotes de reactivos o kits de pruebas nuevos. Este examen suele incluir el análisis de una muestra de los materiales nuevos y la comparación de los resultados con los de un lote de materiales existente con rendimiento conocido. Es preferible realizar este control de los lotes nuevos de kits comercializados en el nivel central (por ejemplo, en el laboratorio nacional de referencia de TB) o regional, con lo cual se garantiza que no se distribuyan los kits que no sean aprobados. En el centro de pruebas, es necesario controlar los lotes nuevos de reactivos preparados localmente y también puede necesitarse para verificar las condiciones durante el transporte y el almacenamiento de los kits en el país. Para el control de la calidad de nuevos lotes de reactivos, la OMS recomienda usar testigos positivos y negativos.
Área 5: Procedimientos
5.1 Elaborar los POE.
5.2 Actualizar los procedimientos clínicos y fortalecer los vínculos entre la atención clínica y el laboratorio.
Paso 5.1 Elaborar los POE
En función del uso o los usos previstos de la prueba diagnóstica, se tienen que definir, seleccionar, elaborar o adaptar los procedimientos, con los siguientes fines:
- reconocer a los pacientes a los que se realizará la prueba;
- obtener, procesar, almacenar y transportar las muestras al laboratorio de pruebas;
- realizar las pruebas de laboratorio;
- analizar los datos y procurar su seguridad y confidencialidad (véase el área 6);
- controlar los procesos (control de calidad interno) y realizar la evaluación externa de la calidad (véase el área 7); y
- registrar y comunicar los resultados (véase el área 8).
Será importante contar con un conjunto bien definido y exhaustivo de procedimientos operativos estandarizados ( POE) que aborden todos los aspectos de los procesos de las pruebas de laboratorio, desde la obtención de las muestras hasta la comunicación de los resultados; en parte, porque los errores en cualquier paso pueden tener una repercusión considerable sobre la calidad de la prueba. Algunos POE consistirán en los protocolos del fabricante incluidos en los estuches comerciales y otros deberán elaborarse. Los POE deben ponerse al alcance del personal y se deben actualizar periódicamente.
Paso 5.2 Actualizar los procedimientos clínicos y fortalecer los vínculos entre la atención clínica y el laboratorio
Un plan exhaustivo de implementación de una nueva prueba diagnóstica debe abordar todas las partes pertinentes de la secuencia diagnóstica, no solo lo que sucede en el laboratorio. Además de los POE relacionados con el laboratorio, se necesitarán protocolos y orientaciones clínicas claras para seleccionar los pacientes que deben someterse a la prueba, solicitar las pruebas, interpretar sus resultados y tomar las decisiones en relación con la atención al paciente. Antes de utilizar una prueba diagnóstica nueva, también es necesario que todo el personal clínico que participa en el diagnóstico y el manejo de los pacientes se familiarice con los procedimientos actualizados. Asimismo, es importante sensibilizar al personal clínico de los centros que derivan pacientes, mediante la capacitación del personal junto con materiales impresos normalizados, elaborados por el programa nacional de TB.
Debe vigilarse la tasa de solicitud de la prueba nueva, con el objeto de asegurarse de que el personal clínico que debe estar ofreciendo la prueba en todos los centros, en realidad sí la solicita. El personal clínico en los centros con una tasa de pruebas baja puede necesitar capacitación y sensibilización complementarias.
Área 6: Datos digitales
6.1 Establecer el uso de datos digitales y la conectividad de los medios de diagnóstico.
6.2 Establecer procedimientos para el respaldo, la seguridad y la confidencialidad de los datos.
Paso 6.1 Establecer el uso de datos digitales y la conectividad de los medios de diagnóstico
Muchas de las plataformas de pruebas más recientes brindan la posibilidad de utilizar datos digitales. El plan de implementación debe tener en cuenta las necesidades de programas y equipos informáticos, que permitan aprovechar los datos digitales.
La conectividad en el diagnóstico (23) se refiere a la capacidad de vincular los dispositivos de pruebas diagnósticas que producen resultados en formato digital, de tal manera que se transmitan los datos de manera fiable a una diversidad de usuarios. Las principales características de los sistemas son la capacidad de realizar el seguimiento del rendimiento a distancia, ocuparse de la garantía de la calidad y gestionar las existencias. Con la supervisión remota, las personas designadas pueden usar cualquier computadora con conexión a internet para obtener acceso a los programas informáticos que ofrecen una visión general de los establecimientos, los dispositivos y los productos en la red. El programa puede dar seguimiento al consumo y las existencias con el fin de evitar los desabastecimientos y la caducidad de los suministros. El sistema también puede detectar los lotes de productos o instrumentos específicos con un rendimiento bajo o con tasas de error anormales con fines de garantía de la calidad y un servicio preventivo que evite el fallo de los equipos. Este método ofrece una manera sumamente costo-efectiva de garantizar que una red de dispositivos de diagnóstico funcione adecuadamente.
Los datos también pueden transmitirse automáticamente a:
- los médicos y los pacientes, lo cual facilita un seguimiento más rápido de los pacientes;
- los sistemas de gestión de la información de laboratorio o los registros electrónicos, con lo cual se ahorra tiempo del personal, se disminuye la probabilidad de errores de transcripción y se facilitan en gran medida los procesos de seguimiento y evaluación; y
- el programa nacional de TB con el fin de contribuir a la vigilancia de las tendencias de las enfermedades o los perfiles de resistencia y mejorar la capacidad del programa de generar los datos necesarios para varios de los indicadores de desempeño de la Estrategia Fin de la TB.
Paso 6.2 Establecer procedimientos para el respaldo, la seguridad y la confidencialidad de los datos
Con todo sistema electrónico de datos existe un riesgo de pérdida de los datos de las pruebas. Es fundamental contar tanto con un POE para hacer copias de seguridad de los datos periódicamente (por ejemplo, a un disco duro externo), como con un POE de recuperación de datos. Asimismo, tienen que existir normas y procedimientos que garanticen la seguridad de los datos de laboratorio y la confidencialidad de los datos de los pacientes, en conformidad con las regulaciones nacionales e internacionales.
Área 7: Garantía, control y evaluación de la calidad
7.1 Poner en marcha un programa integral de garantía de la calidad.
7.2 Establecer controles de la calidad y hacer el seguimiento correspondiente.
7.3 Elaborar un programa de evaluación externa de la calidad.
7.4 Hacer el seguimiento y analizar los indicadores de la calidad.
Paso 7.1 Poner en marcha un programa integral de garantía de la calidad
Se necesita un programa integral de garantía de la calidad o de gestión de la calidad con el fin de garantizar la precisión, la fiabilidad y la reproducibilidad de los resultados de las pruebas. Los elementos esenciales de un sistema de garantía de la calidad incluyen los siguientes:
- los POE, la capacitación y la evaluación de la competencia (área 9);
- la verificación y el mantenimiento de los instrumentos (área 3);
- la validación o la verificación de los métodos (área 2);
- la verificación entre lotes (área 4);
- control interno de la calidad;
- la evaluación externa de la calidad; y
- el seguimiento de los indicadores de la calidad y la mejora continua de la calidad.
En la guía práctica de la GLI para el fortalecimiento de los laboratorios de TB (24) puede encontrarse un análisis exhaustivo de los principales elementos de un sistema de garantía de la calidad. En esta sección se describen el control interno de la calidad, la evaluación externa de la calidad y el seguimiento de los indicadores de la calidad.
Paso 7.2 Establecer controles de la calidad y hacer el seguimiento correspondiente
Las actividades de control de la calidad se relacionan con la fase analítica de las pruebas, con el objeto de detectar los errores debidos a una falla de la prueba, las condiciones ambientales o el desempeño de los operadores, antes de informar los resultados. El control interno de la calidad incluye normalmente el examen de materiales testigos o sustancias conocidas al mismo tiempo y de la misma manera que las muestras de pacientes, con el fin de verificar la exactitud y la precisión del proceso analítico. Si los resultados del control de la calidad no son aceptables (por ejemplo, se obtienen resultados positivos con los testigos negativos), no se pueden informar los resultados de los pacientes.
Paso 7.3 Elaborar un programa de evaluación externa de la calidad
Un programa de evaluación externa de la calidad incluye el seguimiento de los indicadores de la calidad y del desempeño, las pruebas de competencia, la comprobación o comparaciones entre laboratorios, la supervisión periódica de apoyo en el mismo centro y la retroalimentación oportuna, las medidas correctivas y el seguimiento. En la supervisión de apoyo se debe dar prioridad a los centros con un desempeño deficiente detectados en las pruebas de competencia, el seguimiento mensual de los indicadores de desempeño o las evaluaciones realizadas en los propios centros. El hecho de no estar inscrito en un programa integral de evaluación externa de la calidad implica desaprovechar la oportunidad de detectar y corregir los problemas que alteran la calidad de las pruebas.
La estructura de la gobernanza de un programa de evaluación externa de la calidad a nivel nacional y los niveles de supervisión pueden de variar en los diferentes países. En muchos países la aplicación de las normas y los procedimientos nacionales se coordinada a nivel central en el Ministerio de Salud, el programa nacional de TB o el laboratorio nacional de referencia de TB. En algunos entornos, sobre todo en los países grandes, estas actividades pueden descentralizarse a nivel regional. En general, el nivel central proporciona las políticas, la orientación y las herramientas para las actividades normalizadas de garantía de la calidad, y los niveles regionales y distritales ponen en marcha y supervisan las actividades de garantía de la calidad y vigilan el cumplimiento de los procedimientos. A su vez, los datos recopilados en los centros de pruebas se examinan a escala regional y central, y se utilizan para fundamentar y actualizar las normas y los procedimientos.
Pruebas de competencia
Para muchas pruebas de laboratorio, el programa de evaluación externa de la calidad incluye las pruebas de competencia, que determinan la calidad de los resultados generados en el centro. Las pruebas de competencia comparan los resultados del centro con resultados de referencia y permite determinar si los centros de pruebas tienen resultados comparables. La finalidad de estas pruebas es reconocer los centros con deficiencias graves en las pruebas, ayudar a dirigir el apoyo hacia los centros con desempeño más deficiente y evaluar la competencia de los usuarios después de la capacitación.
Comprobación de los resultados de las muestras
Las comparaciones entre los laboratorios también se pueden utilizar a manera de evaluación externa de la calidad. El procedimiento suele incluir la reevaluación de las muestras en un laboratorio de nivel superior. Muchos laboratorios de TB están familiarizados con este método, porque la reverificación a ciegas es un método corriente de evaluación externa de la calidad de la baciloscopia.
Visitas de supervisión al centro
Las visitas de supervisión al centro tienen gran importancia durante las etapas iniciales de implementación de una prueba nueva, porque aportan motivación y apoyo al personal. Las visitas de supervisión son una oportunidad de impartir capacitación para la actualización, brindar tutoría, consejos para la solución de problemas y actualizaciones técnicas. Estas evaluaciones se deben documentar usando listas de verificación normalizadas, que garantizan la homogeneidad y la integridad de la información y permiten la supervisión de las tendencias y el seguimiento de las recomendaciones y las medidas correctivas. Un programa de este tipo requiere planificación y recursos considerables (tanto económicos como humanos).
Paso 7.4 Hacer el seguimiento y analizar los indicadores de la calidad
El seguimiento sistemático de los indicadores de la calidad, también conocidos como indicadores de desempeño, es un elemento fundamental de la garantía de la calidad de toda prueba diagnóstica. Además de los indicadores generales de calidad del laboratorio recomendados en la guía pertinente de la GLI (24), es necesario adaptar los indicadores de la calidad específicos de la nueva prueba diagnóstica a partir de las directrices internacionales o crearlos de cero. Los datos de los indicadores se deben recopilar en un formato normalizado y analizarlos cada mes o cada trimestre, desglosados según las pruebas.
Los programas deben establecer una línea de base para todos los indicadores. Se deben fijar las metas de todos los indicadores a los que se da seguimiento y documentar e investigar todo cambio inexplicable en los indicadores de la calidad (por ejemplo, un aumento de las tasas de error o un cambio en la positividad del complejo M. tuberculosis). En todos los centros que realizan una prueba específica se debe usar un conjunto normalizado de indicadores de la calidad, que permita la comparación entre los centros.
El proceso de mejoramiento continuo de la calidad es un método cíclico, continuo, orientado por los datos y destinado a mejorar la calidad de las pruebas diagnósticas. El proceso se basa en un ciclo de seguimiento de los indicadores de la calidad, planificación de intervenciones que corrijan o mejoren el desempeño, y ejecución de las intervenciones. El gerente del laboratorio debería examinar los indicadores de la calidad y siempre vincularlos con las medidas correctivas, si se observa algún resultado o tendencia inesperados. Una parte fundamental del proceso consiste en documentar las medidas correctivas y el consecuente mejoramiento y normalización de los indicadores del laboratorio después de las medidas correctivas.
Área 8: Registro y comunicación de resultados
8.1 Examinar y revisar los formularios de solicitud de examen y de comunicación de los resultados.
8.2 Examinar y revisar los registros clínicos y de laboratorio.
Paso 8.1 Examinar y revisar los formularios de solicitud de examen y de comunicación de los resultados
En función del formato vigente del formulario de solicitud de laboratorio del país (es decir, la solicitud de examen de una muestra), pueden ser necesarias revisiones para adaptarlos a unanueva prueba diagnóstica. Los países deben determinar si se precisa una actualización de los formularios de solicitud de examen, teniendo en cuenta el costo y el tiempo necesario para esta revisión. Cuando aún no haya un sistema en el país, se debe introducir un mecanismo de numeración con el objeto de reconocer las muestras repetidas del mismo paciente y de hacer el seguimiento de la proporción y el rendimiento de las pruebas repetidas.
Dado que los datos de los pacientes (por ejemplo, situación con respecto al tratamiento) son fundamentales en la interpretación correcta de los resultados de la prueba, los programas deben procurar que el formulario de solicitud de examen capte esta información. En muchos países, los formularios de solicitud ya incluyen espacios para estos datos, pero se rellenan de manera incompleta o inconstante. Es importante impartir capacitación para la actualización del personal clínico y de laboratorio, con el fin de que los formularios se llenen de manera correcta y completa.
Los formularios utilizados para informar los resultados de la prueba deben conciliar la necesidad de transmitir información sobre la prueba y también la información esencial para que el médico interprete los resultados y actúe en consecuencia sin demora. Es importante que el formato sea fácil de leer, dada la posibilidad de una gran diversidad en el nivel de experiencia que pueden tener los médicos que interpretan los resultados de las pruebas.
Paso 8.2 Examinar y revisar los registros clínicos y de laboratorio
Los registros clínicos y de laboratorio vigentes que se basan en el marco de notificación de la OMS (6) pueden necesitar modificaciones con el fin de registrar los resultados de la prueba diagnóstica que se introduce. Asimismo, puede ser necesario modificar los formularios para los registros propios del laboratorio. Los países deben aplicar una estrategia normalizada para incluir los resultados de las pruebas en los registros clínicos y de laboratorio, y utilizarla de manera sistemática en todos los centros de atención y los centros que realizan las pruebas.
Área 9: Capacitación y evaluación de las competencias
9.1 Elaborar y ejecutar un plan y una estrategia de capacitación.
9.2 Evaluar y documentar las competencias del personal.
Paso 9.1 Elaborar y ejecutar un plan y una estrategia de capacitación
La capacitación y la evaluación de competencias son fundamentales para generar resultados de las pruebas con garantía de la calidad. La implementación de una prueba diagnóstica requiere cierta capacitación que va más allá de los pasos necesarios para llevar a cabo la prueba y, con frecuencia, la formación suministrada por el fabricante en el centro después de la instalación es demasiado corta para cubrir las actividades de garantía de la calidad. El gerente del centro de pruebas debe asegurarse de que los usuarios de las pruebas reciban la capacitación sobre el funcionamiento y el mantenimiento del equipo, la realización correcta de la prueba y las actividades conexas de garantía de la calidad.
Es importante impartir capacitación o lograr la sensibilización de los médicos al mismo tiempo que la formación del personal de laboratorio, con el fin de que todo el personal clínico que participa en la detección sistemática y la atención a los pacientes con TB:
- comprenda los beneficios y las limitaciones de la prueba nueva; y
- esté familiarizado con el algoritmo, el proceso de solicitud, los requisitos de las muestras, los procedimientos de derivación de muestras y la interpretación de los resultados de la prueba nueva.
Paso 9.2 Evaluar y documentar las competencias del personal
Las evaluaciones de las competencias se deben realizar usando una plantilla normalizada después de la capacitación y luego de manera periódica (por ejemplo, cada año). Deben incluir un análisis de los conocimientos y las aptitudes para cumplir cada una de las tareas que requiere una prueba diagnóstica. Las evaluaciones deben estar a cargo de un usuario de la prueba experimentado o un instructor, y deberían incluir la observación de la persona evaluada, mientras realiza independientemente cada una de las tareas necesarias. En estas evaluaciones se pueden utilizar paneles conformados para evaluar las competencias. Los resultados deben registrarse en los archivos del personal.
Área 10: Seguimiento y evaluación
10.1. Hacer el seguimiento de la implementación de la prueba diagnóstica.
10.2. Hacer el seguimiento y evaluar el impacto de la prueba diagnóstica.
Paso 10.1 Hacer el seguimiento de la implementación de la prueba diagnóstica
Durante la fase de planificación inicial, los países deben establecer un conjunto de indicadores clave e hitos que se pueden usar para dar seguimiento al proceso de implementación. Una vez que se han puesto en marcha los servicios de pruebas, se debe dar seguimiento a la utilización de los servicios.
Paso 10.2 Hacer el seguimiento y evaluar el impacto de la prueba diagnóstica
Un marco de seguimiento y evaluación del impacto de una prueba diagnóstica es primordial para fundamentar la toma de decisiones. A menudo, el objetivo de las pruebas diagnósticas de la TB nuevas o mejoradas es fortalecer la confirmación por el laboratorio del diagnóstico de TB o la detección de farmacorresistencia. Para cada objetivo de una prueba se deben definir indicadores que evalúen su impacto. Los programas deben definir para cada indicador su propósito, metas, elementos y fuentes de datos; cómo se calculará; los indicadores del proceso; y los elementos de datos correspondientes que contribuyen al indicador principal. Los análisis en profundidad de los indicadores de los procesos pueden ser útiles, a manera de investigaciones de seguimiento, a fin de establecer la contribución de la prueba a los resultados y poner de manifiesto las oportunidades para intervenciones que aumenten el impacto. Como parte de la demostración del impacto de una prueba y para contribuir a la formulación de planes y políticas, los programas deben considerar la evaluación de la costo-efectividad y analizar la perspectiva de los usuarios de una prueba, un año después de la implementación y luego periódicamente durante los tres a cinco años siguientes. La perspectiva de los usuarios debe abordar los aspectos de aceptabilidad y factibilidad en los principales grupos de usuarios como el personal de salud (por ejemplo, personal médico, de enfermería y agentes comunitarios de salud), los técnicos de laboratorio y los pacientes.