Перекрёстные ссылки книги для 6.1 Drug safety and adverse drug reactions
Меры, принимаемые в связи с нежелательными явлениями
Поскольку у людей, получающих ПЛТ, как правило, нет иных проблем со здоровьем, то любые нежелательные явления, возникающие во время профилактического лечения, должны быть сведены к минимуму. При возникновении серьезной нежелательной реакции следует незамедлительно прекратить ПЛТ и начать поддерживающую терапию. Если нежелательные явления имеют легкую или умеренную степень тяжести, то медработник может сделать выбор в пользу консервативного подхода и продолжения терапии под наблюдением специалиста.
По возможности следует действовать на усмотрение врача и собрать полный анамнез пациента, включая прием сопутствующих лекарственных препаратов и добавок. Для оценки нежелательных явлений и выбора мер по их устранению можно руководствоваться следующим перечнем вопросов:
1. Какова степень тяжести нежелательного явления (легкая, умеренная, тяжелая)?
2. Насколько серьезным является нежелательное явление (может ли оно привести к гибели человека или создать угрозу для его жизни; к госпитализации или продлению срока госпитализации; к значительной и стойкой инвалидности; к врожденным порокам развития)?
3. Какие незамедлительные меры могут быть приняты (беседа с пациентом, лечение симптомов, приостановка/прекращение ПЛТ, необходимость вмешательства для предотвращения тяжелых исходов)?
4. Что стало причиной возникновения такого явления (связь с приемом препаратов, иные факторы)?
5. Как нежелательное явление повлияет на соблюдение режима лечения в дальнейшем (переносимость, возможность замены препарата и использования альтернативного режима)?
6. Какими должны быть следующие шаги (продолжение или возобновление лечения, смена препарата, последующее наблюдение и повторная оценка состояния пациента)?

A. Изониазид и рифампицин (64)
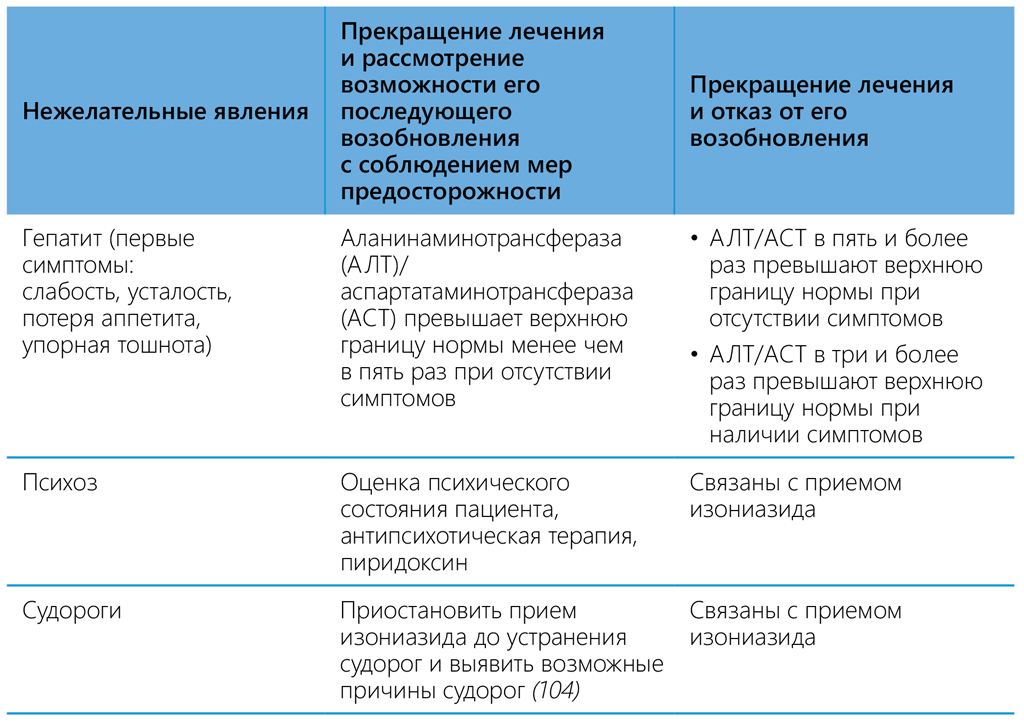
- Медикаментозный гепатит
- Признаки, указывающие на необходимость прекращения приема препарата. В первые недели лечения может наблюдаться временное бессимптомное повышение уровня трансаминаз в сыворотке крови. Подобная реакция не требует прерывания или пересмотра лечения за исключением случаев, когда она сопровождается отсутствием аппетита, недомоганием, рвотой или клинически подтвержденной желтухой. К клиническим признакам, которые являются основанием для беспокойства, относятся упорная рвота, изменения психического состояния и признаки кровотечения, так как все они свидетельствуют об угрозе острой печеночной недостаточности и требуют незамедлительного прекращения приема препарата.
- Меры, принимаемые при возникновении желтухи и других серьезных симптомов. В случае возникновения желтухи или иных клинических проявлений, указывающих на острую печеночную недостаточность, следует прекратить прием всех препаратов до устранения желтухи или симптомов гепатита и возвращения печеночных ферментов к начальным значениям. Если измерить уровень печеночных ферментов не представляется возможным, то начинать ПЛТ следует не ранее чем через две недели после исчезновения проявлений желтухи. Необходимо также расследовать другие возможные причины гепатита.
- Возобновление приема. После устранения гепатита допускается возобновление прежнего режима лечения – как постепенно, так и сразу в полном объеме («пробное возобновление применения препарата»). Однако, если гепатит протекал в тяжелой форме, представляющей угрозу для жизни, и никаких иных предпосылок для его возникновения (таких как потребление алкоголя или вирусная инфекция) не наблюдалось, может быть рекомендована смена режима лечения.
- Кожные реакции
- Зуд без сыпи или с небольшой сыпью. Возможно симптоматическое лечение антигистаминными препаратами с продолжением ПЛТ
- Зуд, сопровождающийся умеренной или обильной сыпью. При возникновении обильной сыпи или признаков поражения слизистых оболочек, гипотензии или серьезного заболевания следует рассмотреть возможность назначения кортикостероидной терапии. Пациент должен принимать преднизолон перорально в дозировке 40–60 мг/сут до возникновения положительной динамики в ответ на лечение. В последующие дни доза препарата должна быть постепенно снижена с учетом его клинической эффективности. ПЛТ должно быть приостановлено до полного исчезновения нежелательной реакции. В случае возникновения начальной острой кожной реакции допускается увеличение полной дозы с использованием более низких начальных провокационных доз. При острой реакции препарат, который предположительно стал причиной таких проявлений, следует отменить и рассмотреть возможность назначения альтернативного режима лечения.
- Лица с пеллагрой, вызванной приемом изониазида, могут полностью восстановить здоровье после отказа от изониазида и получения высоких доз никотинамида (форма витамина B3), однако при отсутствии лечения пеллагра может стать причиной тяжелого заболевания и смерти (103). При пеллагре рекомендуется прием никотинамида в дозировке 300 мг/сут в течение трех-четырех недель. Витамин B3 в больших количествах содержится в тех же продуктах питания, что и витамин B6.
- Периферическая нейропатия
- Для профилактики периферической нейропатии следует назначать витамин B6 (пиридоксин) в дозировке 10–25 мг/сут или комплекс витаминов группы B.
- При подтверждении периферической нейропатии следует увеличить дозу пиридоксина до 100–200 мг/сут. См. также более подробную информацию о пиридоксине в главе 5.
- Нарушение работы ЖКТ на фоне приема рифампицина (боли в животе, тошнота, рвота). Если симптомы носят умеренный характер, то подобные реакции обычно проходят самостоятельно, и в этом случае достаточно лишь успокоить пациента. Если желудочнокишечная непереносимость носит настолько тяжелый характер, что возникает риск перерыва в лечении, следует временно приостановить прием рифампицина (три-четыре дозы), использовать препараты, облегчающие симптомы (например, метоклопрамид в качестве противорвотного средства), или, в самом крайнем случае, давать рифампицин вместе с небольшим количеством пищи, чтобы сделать возможным дальнейший прием препарата. Хотя прием рифампицина с пищей несколько снижает уровень его абсорбции, этот вариант является более предпочтительным, чем полный отказ от лечения рифампицином.
- Вялость: успокоить пациента
- Окрашивание физиологических жидкостей (моча, слезы, семенная жидкость и пот) в красный или оранжевый цвет: успокоить пациента.
B. Изониазид и рифапентин
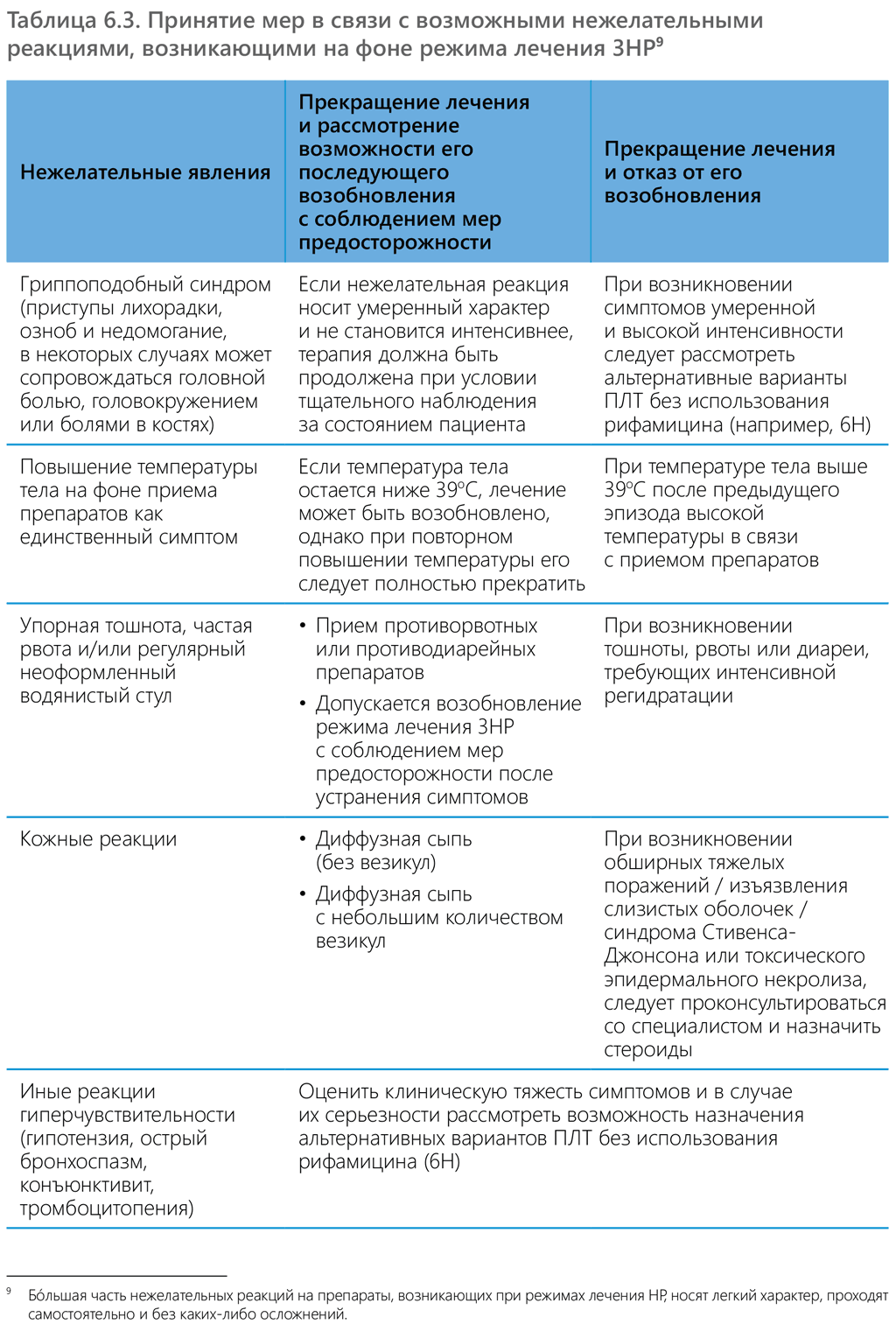
Важно: рифамицины являются сильными индукторами ферментов, и возникновение любых побочных эффектов нужно оценивать и устранять с учетом возможных межлекарственных взаимодействий (см. более подробную информацию в настоящей главе).
C. Плановый мониторинг. Плановый мониторинг должен включать контроль переносимости и соблюдения режима лечения. При каждом взаимодействии с человеком, получающим ПЛТ, необходимо обращать внимание на следующие аспекты:
- признаки или симптомы заболевания ТБ (внезапное резкое проявление симптомов заболевания или постановка неверного диагноза в начале ПЛТ);
- беременность: необходимо прекратить лечение по режиму 3HP и рассмотреть альтернативный режим ПЛТ (например, КПФД, включающий в себя изониазид, витамин B6 и ко-тримоксазол);
- нежелательные явления: тип, начало и продолжительность, тяжесть;
- оценка соблюдения режима лечения и оказание необходимой поддержки: любые перерывы в лечении следует обсуждать с человеком, получающим ПЛТ, и его помощником в лечении; принимать меры для устранения факторов, препятствующих соблюдению режима лечения;
- иные заболевания, например малярия;
- соответствующий медицинский осмотр;
- проверка любых лекарственных препаратов (включая средства народной медицины), которые могут вступать во взаимодействие с ПЛТ;
- проведение ФПП в случае повышенного уровня печеночных ферментов, зафиксированного на начальном этапе или во время предыдущего визита, а также при регулярном употреблении алкоголя в анамнезе. При назначении ПЛИ беременным плановое проведение ФПП не требуется при условии отсутствия других факторов риска гепатотоксичности.

Национальным программам необходимо создать механизм для систематического учета любых нежелательных явлений, возникающих на фоне ПЛТ. Предполагаемые или подтвержденные нежелательные реакции на лекарственные препараты подлежат незамедлительному устранению и доведению до сведения национального управления по вопросам фармаконадзора в соответствии с местными нормативами. Для оценки наиболее распространенных видов нежелательных явлений и последующего внесения изменений в программу с целью минимизации случаев их возникновения важно проводить периодическую проверку медицинский карт.
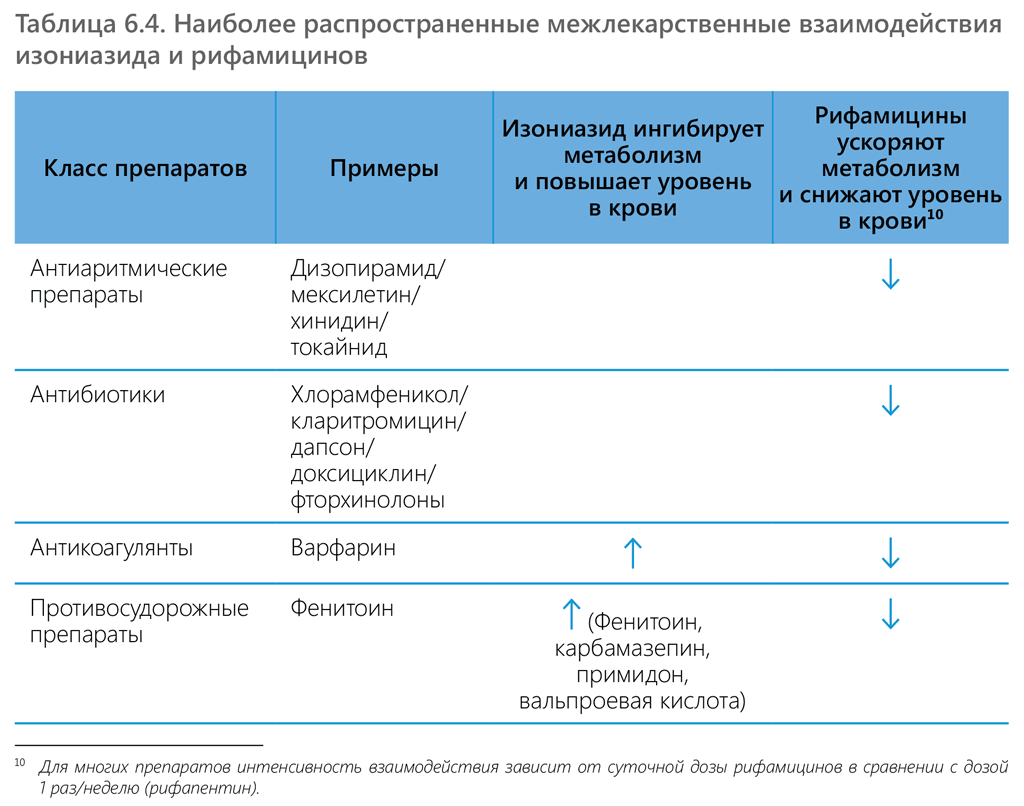
Межлекарственные взаимодействия
Рифамицины и АРВ препараты
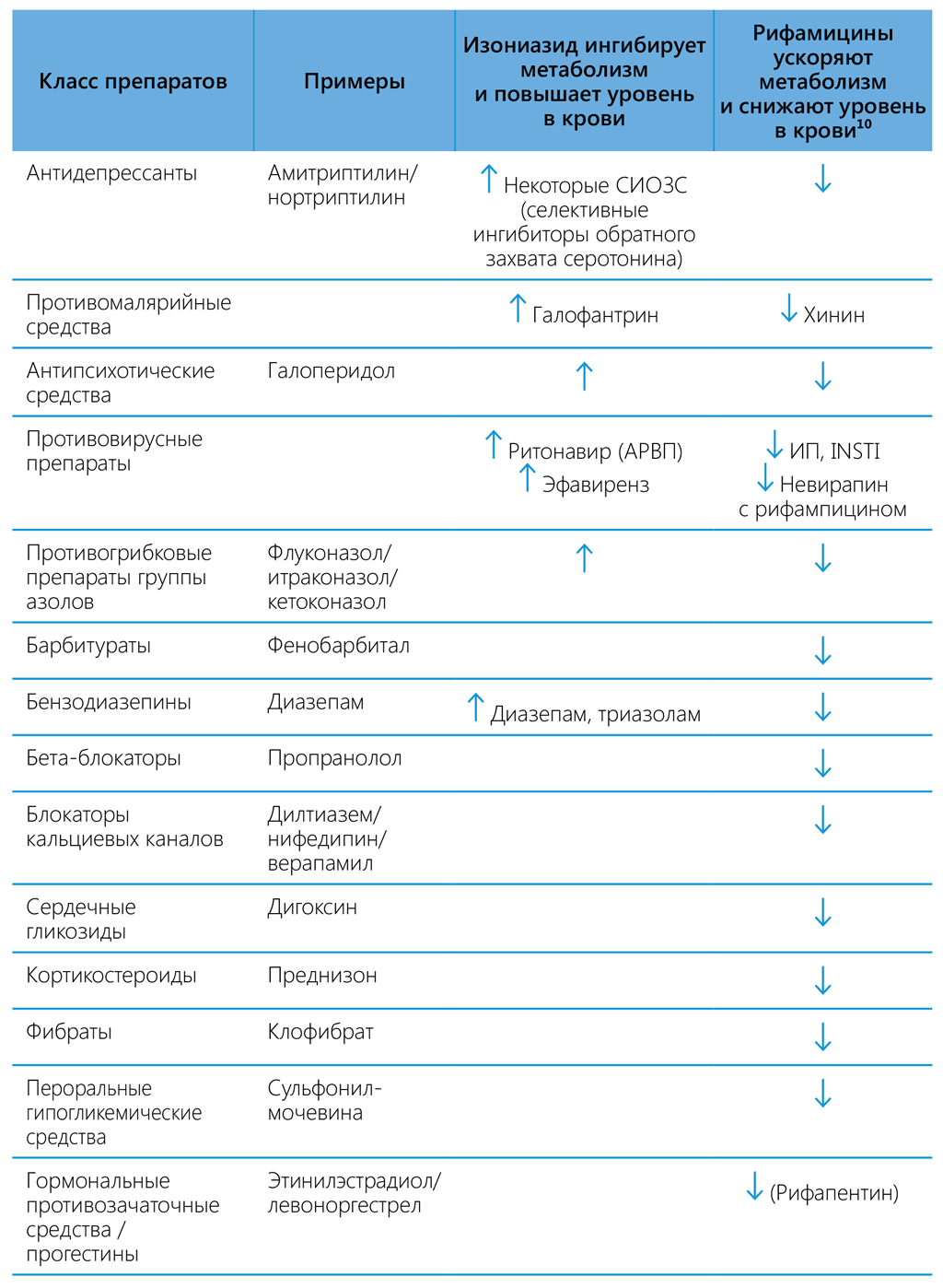
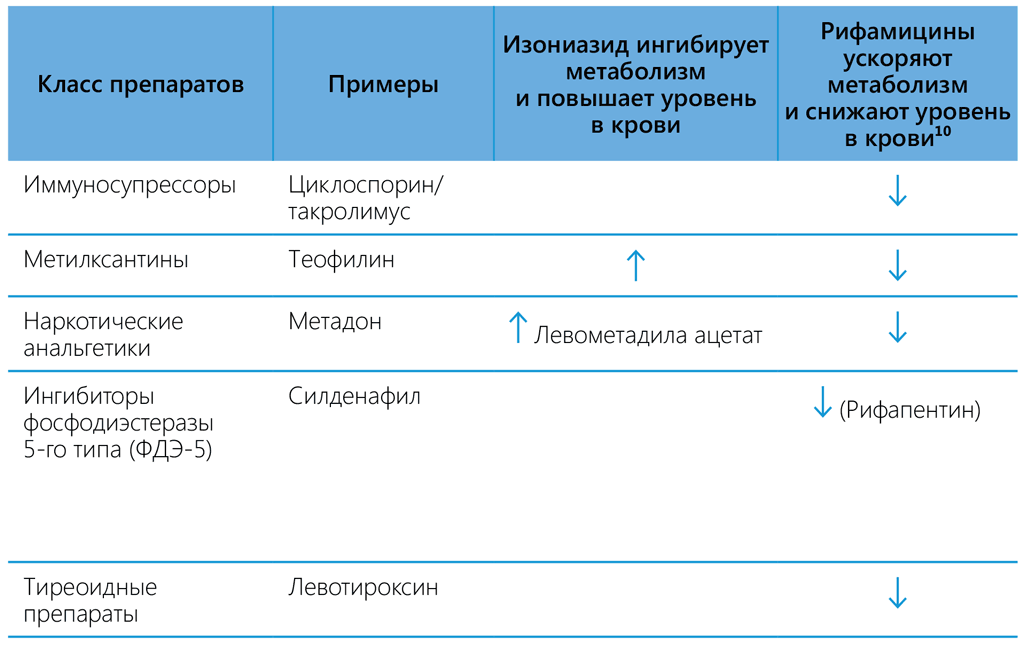
При одновременном приеме рифамицинов и АРВ препаратов воздействие любого из этих лекарственных средств на организм человека может меняться. Межлекарственное взаимодействие может приводить к усилению или ослаблению действия как одного, так и обоих препаратов, снижению их эффективности или возникновению нежелательных явлений. Рифамицины являются сильными индукторами метаболизма ферментов, включая ферменты семейства цитохрома Р450, и потому могут влиять на действие препаратов, проходящих эти метаболические пути, ускоряя их вывод из организма. Рифампицин, в частности, является сильным индуктором цитохромов Р450 (преимущественно, подсемейств 3A и 2C), P-гликопротеина (P-gp) и фермента уридиндифосфат-глюкуронозилтрансферазы 1A. Точно так же рифапентин индуцирует ферменты P450, в первую очередь изоферменты CYP3A4, CYP2C8 и CYP2C9 (105). Рифампицин и рифапентин являются одинаково сильными индукторами, тогда как у рифабутина индуцирующие свойства выражены менее ярко. Вследствие этого рифамицины ускоряют метаболизм многих дополняющих препаратов, включая некоторые АРВП. Одновременный прием этих АРВ препаратов и рифамицинов может снизить биодоступность АРВП и повысить риск неэффективности лечения ВИЧ-инфекции или риск возникновения устойчивости. К АРВ средствам, которые подвергаются наиболее серьезному воздействию в результате индукции изоферментов цитохрома Р450, обусловленной приемом рифамицина, относятся все ингибиторы протеазы (PIs), ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), ингибиторы переноса цепи интегразы (INSTI) (такие как долутегравир) и антагонисты хемокинового рецептора CCR5 (такие как маравирок). Рифамицины также взаимодействуют со многими другими препаратами, перечисленными в таблице 6.4. Таким образом, при одновременном приеме этих препаратов и рифамицина, входящего в какой-либо из режимов ПЛТ, необходимо провести тщательную клиническую оценку и либо отказаться от указанных режимов лечения, либо скорректировать дозировку других одновременно принимаемых препаратов (106).
В целом следует с осторожностью назначать режимы лечения, содержащие рифампицин и рифапентин, у людей, живущих с ВИЧ и получающих АРТ. Такие режимы не подходят людям, живущим с ВИЧ, которые получают ингибиторы протеазы или невирапин. При одновременном приеме рифампицина и эфавиренза коррекция дозы не требуется, однако при сочетании рифампицина и долутегравира дозировка последнего должна быть увеличена до 50 мг 2 раза/сут для взрослых (107). Такая доза хорошо переносится и имеет эффективность, сопоставимую с эфавирензом по таким параметрам, как вирусная супрессия и восстановление уровня клеток CD4 (108). Режим 3HP может быть назначен людям, получающим АРТ с использованием эфавиренза, без корректировки дозы (109). Одновременный прием рифапентина и ралтегравира также хорошо переносится и является безопасным (110).
Одновременный прием рифапентина и долутегравира
Доказано, что прием рифапентина один раз в неделю приводит к ослаблению действия долутегравира, однако, несмотря на это, уровень долутегравира в крови по-прежнему превышает целевые показатели концентрации, обеспечивающие вирусную супрессию у взрослых людей, принимающих оба препарата. Согласно результатам одного из исследований, снижение концентрации долутегравира в крови (даже на 75–80%), как правило, не является клинически значимым, так как даже доза, составляющая 10 мг долутегравира 1 раз/сут (в сочетании с нуклеотидным ингибитором обратной транскриптазы (НИОТ)), обеспечивает высокий уровень вирусной супрессии в течение 96 недель, что по воздействию сопоставимо с режимом лечения, содержащим эфавиренз (111). Таким образом, долутегравир можно назначать одновременно с приемом рифапентина 1 раз в неделю без какой-либо коррекции дозы.
Доказано, что одновременный прием этих препаратов в целом является безопасным. Результаты фаз I/II исследований, в ходе которых взрослые ЛЖВ с подавленной вирусной нагрузкой получали одновременно режим 3HP и долутегравир, показали, что такое лечение хорошо переносится и позволяет поддерживать вирусную супрессию. Никаких сведений о нежелательных явлениях третьей степени не поступало, и полученные выводы свидетельствуют о том, что необходимость корректировать дозу долутегравира для взрослых ЛЖВ, получающих АРТ на базе долутегравира, отсутствует (112).
Однако в настоящее время нужны дополнительные исследования фармакокинетики одновременного приема препаратов режима 3HP и других препаратов, особенно таких как усиленные ингибиторы протеазы и тенофовира алафенамид, в том числе при лечении беременных женщин и детей. Сегодня ведутся исследования, в рамках которых оцениваются оптимальные уровни долутегравира при приеме рифапентина 1 раз/сут и необходимость корректировки дозы долутегравира при режиме лечения 1HP как для взрослых, так и для детей (ACTG 5372).
Варианты АРВ терапии, проводимой одновременно с ПЛТ на основе рифамицина
Внесение изменений в АРТ в целях адаптации к конкретному режиму ПЛТ требует крайней осторожности. Врач должен очень тщательно взвешивать все преимущества и риски таких корректив, поскольку частые изменения АРТ могут привести к потере вирусологической эффективности и допускаются только в крайнем случае, особенно если действующий режим АРТ обеспечивает подавление вирусной нагрузки у конкретного человека. Помимо этого, пересмотр АРТ с использованием эфавиренза не является оптимальным решением, если речь идет о регионах с высоким уровнем устойчивости к ННИОТ (включая многие регионы в Африке к югу от Сахары). В целом при принятии решения следует учитывать, что эффективность АРТ имеет большее значение, чем выбор режима ПЛТ. При обдумывании возможности пересмотра режима АРТ для сочетания с режимом ПЛТ, содержащим рифамицин, могут быть рассмотрены следующие варианты.
- Большинство НИОТ и ингибиторов слияния не вступают в существенные лекарственные взаимодействия с рифамицинами.
- Согласно имеющимся фармакокинетическим данным, рифапентин не вступает в существенные межлекарственные взаимодействия с эфавирензом (ННИОТ) (113–115) и ралтегравиром (INSTI) (110).
- Каких-либо значимых фактов межлекарственных взаимодействий при одновременном приеме рифапентина и использовании режимов АРТ, содержащих такие препараты, как абакавир (ABC), эмтрицитабин (FTC), тенофовира дизопроксил фумарат (TDF), ламивудин (3TC) или зидовудин (AZT), отмечено не было. Режимы лечения, содержащие эфавиренз и ралтегравир и используемые в сочетании с ABC/3TC или TDF/FTC, являются совместимыми с 3HP.
Существенным исключением является тенофовира алафенамид, поскольку в качестве субстрата гликопротеина-P он может приводить к недопустимому снижению уровня действия препарата в результате взаимодействия с рифамицинами, например рифапентином. Таким образом, одновременный прием таких препаратов, как тенофовира алафенамид и рифапентин, не рекомендуется до появления новых данных, которые свидетельствовали бы о допустимости их одновременного использования (116). Следует отметить, что при одновременном приеме тенофовира алафенамида и рифампицина достигается такой же внутриклеточный уровень тенофовира дифосфата (TDF-DP), как при приеме исключительно TDF, что указывает на допустимость такого сочетания препаратов, однако клинические данные пока остаются ограниченными (117).
Изониазид
Доказано, что изониазид является ингибитором некоторых ферментов цитохрома P450. Одновременный прием изониазида и лекарственных препаратов, которые претерпевают биотрансформацию в ходе этих метаболических процессов, может снижать темпы выведения препаратов из организма и, как следствие, повышать их концентрацию / усиливать действие. Соответственно, дозировки препаратов, которые метаболизируются этими ферментами, могут потребовать коррекции в начале приема или при прекращении одновременного приема для поддержания оптимального терапевтического уровня препаратов в крови. Известно, что изониазид ингибирует метаболизм таких препаратов, как эфавиренз, противосудорожные препараты, бензодиазепины, галоперидол, кетоконазол, теофилин и варфарин. В настоящее время нет никаких данных о том, какое действие оказывают взаимоисключающие свойства рифампицина и изониазида на метаболизм этих препаратов, но индуцирующие свойства рифампицина, как правило, проявляются с большей силой. Схожие межлекарственные взаимодействия рифамицинов представлены в таблице 6.4.

ПЛТ на основе рифамицина и лечение малярии
Рифампицин и остальные рифамицины являются сильными ингибиторами изофермента CYP3A4 и снижают действие хинина у взрослых людей, получающих противомалярийные препараты, что ведет к пятикратному росту показателей рецидива (64). Точно так же одновременный прием рифамицинов с мефлохином приводит к трехкратному снижению действия последнего. Схожее снижение степени воздействия наблюдалось при одновременном приеме рифампицина и артеметера, дигидроартемизинина и люмефантрина (9-, 6- и 3-х кратное снижение эффективности соответственно). В настоящее время не имеется достаточных фактических данных, которые свидетельствовали бы о необходимости пересмотра текущих рекомендаций относительно дозировок этих противомалярийных препаратов (мг/кг веса тела), и в связи с этим следует вести тщательный мониторинг по причине повышенного риска рецидива. До появления четких фактических данных относительно методов, позволяющих усилить действие противомалярийных препаратов, предлагается руководствоваться следующими рекомендациями.
- Если у человека была диагностирована малярия, а ПЛТ на основе рифамицина еще не начато, то необходимо в первую очередь сосредоточиться на лечении малярии.
- Если у человека, который уже получает ПЛТ на основе рифамицина, была диагностирована малярия, необходимо приступить к одновременному лечению малярии и вести клинический мониторинг в соответствии с национальными рекомендациями, чтобы обеспечить излечение от малярии. В настоящее время нет достаточных фактических данных, которые указывали бы на необходимость коррекции дозировок ПЛТ или КТА (комбинированная терапия с использованием артемизинина).
- Если у человека, который получает ПЛТ, произошел рецидив малярии, необходимо повторно провести лечение малярии в соответствии с национальными руководствами. Приостановление профилактического лечения ТБ требуется только в том случае, если новый режим лечения малярии также содержит препараты, которые вступают в доказанное взаимодействие с рифамицинами. После излечения от малярии ПЛТ может быть возобновлено.
- Если человек соответствует диагностическим критериям тяжелой малярии (помутнение сознания, низкий уровень глюкозы в крови, высокий билирубин/желтуха, кровотечение, анемия, почечная недостаточность и паразитемия >10%), то ПЛТ следует приостановить и экстренно приступить к лечению малярии в соответствии с национальными руководствами. Возобновление ПЛТ рекомендуется только после полного излечения от малярии.
Как долго продолжается защитное действие ПЛТ?
Долговременная защита от ТБ зависит как от силы нейтрализующего воздействия ПЛТ на туберкулезную инфекцию, так и от риска повторного инфицирования после завершения лечения. Ненадлежащее лечение туберкулезной инфекции по причине выбора недостаточно эффективного режима ПЛТ или несоблюдение режима лечения может привести к реактивации туберкулезной инфекции и ее последующему переходу в активную форму заболевания ТБ.
ЛЖВ подвержены повышенному риску реактивации туберкулезной инфекции и ее переходу в заболевание ТБ. В период до появления АРТ был проведен ряд исследований, согласно которым в странах с высоким бременем ТБ после завершения курса ПЛТ риск развития ТБ становился выше, тогда как в странах с низким/средним бременем ТБ профилактическое лечение, напротив, обеспечивало более долгосрочную защиту с точки зрения снижения уровня смертности и заболеваемости ТБ. Согласно последним исследованиям, которые проводились в период широкомасштабной доступности АРТ, даже в странах с высоким бременем ТБ профилактическое лечение обеспечивало такую же длительную защиту, как и в регионах с низким или средним бременем ТБ.
- В Кот-д’Ивуаре, где, по последним данным, заболеваемость ТБ составляет 159 человек на 100 000 населения, шестимесячный курс ПЛИ позволил значительно снизить уровень смертности среди ВИЧ-инфицированных людей, которые начали получать АРТ даже при высоком уровне клеток CD4, и защитное действие терапии сохранялось на период до шести лет (118).
- В Бразилии (страна со средним уровнем распространенности ТБ) ПЛИ привело к значительному снижению риска развития ТБ у ВИЧ-инфицированных людей с положительными результатами ТКП. Проведение шестимесячного курса изониазида привело к снижению риска развития ТБ более чем на семь лет, что резко контрастирует с результатами исследований в странах Африки с высоким бременем ТБ, где заболеваемость ТБ росла сразу после завершения курса ПЛИ (119, 120).
- Выводы, полученные по итогам последних исследований в Мьянме и Индонезии (страны с высоким бременем ТБ), подтверждают продолжительный характер защитного действия шестимесячного курса ПЛИ у людей, живущих с ВИЧ. В Мьянме у людей, завершивших полный курс ПЛИ, наблюдалось значительное снижение риска заболевания ТБ и смертности от ТБ на протяжении восьми лет после завершения терапии. В Индонезии защитное действие лечения сохранялось в течение более чем пяти лет (121, 122).
- В ходе исследования BRIEF-TB (97% участников из стран с высоким бременем ТБ) уровень заболеваемости ТБ после завершения полного курса ПЛТ на основе либо изониазида и рифапентина в течение одного месяца, либо изониазида в течение девяти месяцев оставался стабильным на протяжении последующего трехлетнего контрольного периода после завершения исследования. Почти все ЛЖВ, принимавшие участие в этом исследовании, получали АРТ (54). Среди людей из домашних очагов ТБ инфекции, которые получали ПЛТ в период до терапии ВИЧ, долгосрочное действие профилактического лечения изониазидом сохранялось даже в регионах с очень высоким бременем ТБ.
- В 1960-х годах Служба здравоохранения США профинансировала ряд исследований, цель которых заключалась в оценке эффективности ПЛИ. Объектом исследования стала большая группа жителей Аляски, подверженная риску развития ТБ вследствие недавнего или отдаленного контакта с больными ТБ легких (123). В 1958 г. у 2% населения в этом регионе был выявлен ТБ, и последующая туберкулинодиагностика показала, что средний годовой уровень инфицирования ТБ в этом регионе составил около 8%. Эти показатели превышали все существовавшие до этого момента значения и опережали даже территории с самым высоким уровнем передачи инфекции, включая, например, шахты в ЮАР, где, по имеющимся оценкам, частота таких случаев в 2005 г. составила 4,2% (124). Участники получали изониазид в дозировке 300 мг/сут (5 мг/кг для детей) или такую же дозу плацебо на протяжении одного года. Активное последующее наблюдение проводилось в течение двух лет после завершения лечения, а пассивный сбор данных – в течение следующих 10 лет. Последующие данные исследования, проведенного в 28 поселках и двух школах-интернатах на Аляске в 1958 г., показали, что защитный эффект изониазида сохранялся в течение 19 лет. (125). Расчеты, согласно которым оптимальным является от шести до девяти месяцев профилактической терапии, были получены на основании данных последующего наблюдения в этом исследовании и исследования Международного союза по борьбе с туберкулезом и болезнями легких, которые показали, что прием изониазида продолжительностью более девяти месяцев не приводил к повышению эффективности терапии (69, 126).
- Результаты систематического обзора, опубликованного в 1999 г. (127), подтверждают эффективность изониазида как средства профилактики туберкулеза почти у 60% представителей разных групп риска, включая людей из домашних очагов ТБ инфекции. На каждые 35 человек, контактировавших с ТБ в пределах домохозяйств и получивших положительный результат ТКП с последующим назначением изониазида для профилактического лечения продолжительностью шесть месяцев, в течение следующих пяти лет был предотвращен один случай заболевания ТБ.
Когда следует повторять или заново проводить ПЛТ?
В настоящее время фактические данные, которые свидетельствовали бы о пользе повторения курсов ПЛТ, отсутствуют. В связи с этим в руководстве ВОЗ по ПЛТ за 2020 г. не содержится четких рекомендаций о необходимости повторения курса ПЛТ. В то же время в регионах с высоким уровнем распространения ТБ (согласно определению местных властей) людям, живущим с ВИЧ, рекомендован прием изониазида на протяжении 36 месяцев (в качестве альтернативы пожизненной терапии) (см. рекомендацию ниже). Одним из приоритетных направлений исследований в таких условиях является проведение оценки необходимости повторных курсов с короткими режимами терапии, и, если они требуются, определение их периодичности.

В конце 2019 г. было завершено рандомизированное прагматическое исследование среди ЛЖВ Мозамбика, Эфиопии и ЮАР, получавших АРТ (WHIP3TB). В ходе этого исследования сравнивалась эффективность режима 3HP с однократным (N=1802) или двукратным проведением лечения (N=1808) в течение 14 месяцев и одного курса лечения по режиму 6H (N=404). Показатели завершения полного курса лечения по режиму 3HP были выше, чем при режиме 6H. В ходе последующего наблюдения в течение 24 месяцев после рандомизации были выявлены сопоставимые показатели заболеваемости ТБ, частоты новых случаев рифампицин-устойчивого ТБ и смертности у участников, получавших режим 3HP однократно или двукратно, из чего можно сделать вывод о том, что назначение режима 3HP людям, живущим с ВИЧ и получающим АРТ, в условиях с высоким уровнем распространения ТБ обеспечивает необходимый уровень защиты, а повторение данного курса на ежегодной основе не способствует дополнительному повышению его эффективности (128). Для оценки долгосрочного действия этого режима лечения потребуется более длительное последующее наблюдение за состоянием участников исследования.
В то же время повторение курса ПЛТ может быть рекомендовано людям с положительным или отрицательным статусом ВИЧ, которые ранее прошли ПЛТ в полном объеме, но впоследствии имели тесные или семейные контакты с больными ТБ. Поскольку результаты существующих на сегодняшний день тестов (ТКП и IGRA) не меняются с положительных на отрицательные после завершения полного курса ПЛТ, они не могут быть использованы для выявления необходимости повторения курса лечения в ситуации нового контакта с ТБ инфекцией или повторного инфицирования. В связи с этим необходимо тщательно оценивать интенсивность воздействия и соотношение возможного вреда и пользы при принятии решения относительно необходимости повторения курса ПЛТ.
Повторение курса ПЛТ с самого начала может потребоваться в случае значительного перерыва в лечении. В главах 5 (таблица 5.3) и 7 (таблица 7.1) представлен ряд пороговых значений, позволяющих установить факт потери пациента для последующего наблюдения в рамках разных режимов на основании критериев, которые применялись в ходе исследований. Это еще одна область, в которой наблюдается нехватка достоверных фактических данных относительно «простительности» перерыва в режиме лечения.
Приводит ли ПЛТ к развитию лекарственной устойчивости?
Одно из наиболее распространенных опасений по поводу широкомасштабного применения ПЛТ касается возможного риска развития лекарственной устойчивости. На сегодняшний день качественные фактические данные, которые подтверждали бы обоснованность таких опасений, отсутствуют (58). Ни одно из многочисленных исследований не выявило научных данных, которые указывали бы на существенную связь между лекарственно-устойчивым ТБ и применением изониазида или рифамицина в рамках ПЛТ (129, 130). Подобные опасения фактически лишили бесчисленное множество людей возможности воспользоваться решением, потенциально спасающим жизни.
В большинстве случаев главной причиной лекарственной устойчивости становится ненадлежащее лечение заболевания ТБ. При соблюдении программами по борьбе с ТБ правил ПЛТ, в частности при назначении ПЛТ исключительно людям, у которых отсутствует заболевание ТБ, рост уровня лекарственной устойчивости становится весьма маловероятным. В организме людей с туберкулезной инфекцией присутствует лишь небольшое число бактерий, отличающихся низкой скоростью репликации, и риск того, что в результате ПЛТ произойдет селекция лекарственноустойчивых штаммов, невелик (129). Напротив, ПЛТ может снизить общее бремя заболевания ТБ и сократить число людей, которые рискуют получить ненадлежащее лечение ТБ, способное приводить к развитию и распространению МЛУ-ТБ.
Приступать к ПЛТ можно лишь после исключения заболевания ТБ. При этом требуется регулярное последующее наблюдение для обеспечения соблюдения режима ПЛТ и заблаговременного выявления симптомов ТБ в период терапии. Кроме того, необходимо укреплять эпиднадзор для выявления лекарственной устойчивости среди тех, у кого в течение или после завершения ПЛТ развился ТБ, подтвержденный микробиологическими методами.

Устойчивость к изониазиду после ПЛИ
По итогам систематического обзора 13 исследований, которые были опубликованы за период с 1951 г. и включали в себя 18 095 участников, получавших ПЛИ, и 17 985 участников контрольных групп, не было выявлено никаких фактов, которые указывали бы на повышенный риск развития ТБ с устойчивостью к изониазиду после ПЛИ; стратификация по такому критерию, как ВИЧ, не привела к изменению этих результатов (129). Помимо этого, в группе Тибела (когортное исследование, проведенное в ЮАР) доля людей, заболевших лекарственно-устойчивым ТБ после получения ПЛИ, совсем незначительно отличалась от показателей, которые наблюдались в группах сравнения (131).
Устойчивость к рифамицину после ПЛТ
По итогам анализа шести РКИ, в ходе которых сравнивались режимы ПЛТ на основе рифамицина и активный контроль или применение плацебо, было выявлено, что среди 6808 человек, получавших ПЛТ на основе рифамицина, доля случаев возникновения устойчивости к рифампицину составила 0,09%, тогда как для 7415 человек, получавших альтернативные режимы, этот показатель был равен 0,01% (ОР = 3,45, 95% ДИ = 0,72–16,56; P = 0,12) (130). В трех из указанных исследований, где применялись интермиттирующие режимы ПЛТ на основе рифамицина, из 4673 человек были выявлены два случая устойчивости к рифампицину, тогда как среди 4427 участников контрольных групп был зарегистрирован лишь один такой случай (ОР = 3,89; 95% ДИ 0,44–34,56; P=0,22). В плацебо-контролируемых исследованиях случаи возникновения устойчивости к рифампицину у участников, которые получали режимы лечения на основе рифамицина, выявлены не были, тогда как среди групп, получавших плацебо, было отмечено несколько таких случаев (ОР 0,20, 95% ДИ = 0,02–1,66) (130).
 Обратная связь
Обратная связь