Перекрёстные ссылки книги для 3.3 Remarks
Отвечая на вопрос PICO № 3–2018 (МЛУ/РУ-ТБ, 2018 г.), ГРР 2018 г. оценивала индивидуальное влияние препаратов, используемых в длительных режимах лечения МЛУ-ТБ, на результаты лечения пациентов, опираясь в первую очередь на оценку эффективности из метаанализа ИДП за 2018 г. и клиническое испытание № 213 (деламанид) (см. соответствующие сводки данных GRADE по каждому препарату в приложении 3, web–annex 3 и механизмы принятия решений по методике GRADE в приложении 3, web–annex 4). После тщательной оценки соотношения пользы и вреда для каждого препарата были вынесены рекомендации, разделенные на три группы (см. таблицы 3.1, 3.2 и 3.3).
- Группа А: фторхинолоны (левофлоксацин и моксифлоксацин), бедаквилин и линезолид сочтены высокоэффективными и настоятельно рекомендуются для включения во все режимы при отсутствии противопоказаний.
- Группа B: клофазимин и циклосерин или теризидон условно рекомендованы в качестве препаратов второго выбора.
- Группа C: в нее входят все прочие препараты, которые могут использоваться в том случае, если режим не может быть составлен из препаратов групп A или B. Препараты в группе С отсортированы по стандартно ожидаемому от каждого из них относительному балансу пользы и вреда.
К другим лекарственным средствам, не включенным в группы А–С, относятся следующие.
- Канамицин и капреомицин – препараты, которые приводили к менее благоприятным результатам и поэтому больше не рекомендуются для использования в режимах лечения МЛУ-ТБ.
- Гатифлоксацин, высокодозный изониазид и тиоацетазон – гатифлоксацин и высокодозный изониазид применялись лишь у небольшого количества пациентов, а тиоацетазон не применялся вообще. Гатифлоксацин в настоящее время недоступен в виде препаратов с подтвержденным качеством после того, как подозрения на дисгликемию привели к его отзыву с рынка. Тиоацетазон с минимальной вероятностью будет использоваться в современных длительных режимах; в настоящее время он недоступен в виде препаратов с подтвержденным качеством. Высокодозный изониазид может использоваться для лечения пациентов с подтвержденной чувствительностью к изониазиду (см. раздел 3.4).
- Клавулановая кислота – этот препарат необходимо включать в режим лечения МЛУ/РУ-ТБ только в качестве дополнения к карбапенемам (имипенемциластатину и меропенему). При назначении в этом режиме ее необходимо принимать с каждой дозой карбапенема и не следует рассматривать как дополнительный эффективный противотуберкулезный препарат.
Вынесение рекомендаций в отношении перхлозона, гамма-интерферона или сутезолида оказалось невозможным ввиду отсутствия в соответствующих исследованиях данных об итоговых результатах лечения пациентов.
В отношении применения бедаквилина у пациентов младше 18 лет, исходя из возможности экстраполирования профиля «воздействие – реакция» (эффективность) со взрослых на детей, ГРР пришла к выводу о том, что дозы, оценка воздействия которых на детей и подростков проводилась в двух исследованиях (фаза II исследования TMC207–С211 и фазы I/II исследования IMPAACT P1108; см. приложение 3, web–annex 5), очевидно, не сопровождаются воздействиями, которые повысили бы риск неудачного исхода лечения у пациентов в возрасте 6–17 лет. Согласно имеющимся данным, риски для детей в возрасте от 6 лет, участвовавших в испытаниях (все они имели ВИЧ-отрицательный статус и подвергались ограниченному воздействию других препаратов, удлиняющих QT-интервал), не превышали таковые для взрослых. Вариабельность ограниченного размера выборки не позволила прокомментировать профиль «воздействие – реакция» (безопасность). Помимо этого, ГРР 2018 г. пришла к заключению о том, что аспекты соотношения риска и пользы при применении бедаквилина у пациентов в возрасте 6–17 лет аналогичны таковым у взрослых пациентов; при этом ГРР подчеркнула, что до рассмотрения вопроса о переводе этой рекомендации в категорию настоятельных необходимо получение новых данных.
По результатам анализа, проведенного в 2021 г., ГРР определила, что соотношение между желательными и нежелательными эффектами, вероятно, свидетельствует в пользу применения бедаквилина у детей младше 6 лет. ГРР 2021 г. подчеркнула, что польза от применения препарата может зависеть от конкретных условий и характеристик популяции (например, нутритивного статуса). ГРР также отметила, что в контексте преимуществ коротких режимов без инъекционных препаратов (т. е. сокращения числа поездок, времени, проводимого в медицинском учреждении, и нежелательных реакций) необходимо принимать во внимание потенциально более высокую стоимость бедаквилина в составе режима лечения МЛУ/РУ-ТБ. Помимо этого, члены группы пришли к выводам о том, что доступность бедаквилина для детей младшего возраста приведет к повышению справедливости, поскольку использование этого препарата будет приемлемым для большинства заинтересованных сторон, и что один из основных аспектов осуществимости будет связан с необходимостью мониторинга безопасности бедаквилина (т. е. потребуется доступ к ЭКГ и персонал, способный вести мониторинг). Тем не менее Группа заключила, что внедрение применения бедаквилина у детей младшего возраста, вероятно, является осуществимым.
В отношении применения деламанида у детей в возрасте младше 6 лет ГРР в 2018 г. провела анализ и пришла к заключению, что на основе результатов взрослых пациентов, проанализированных фармакологических данных и данных о безопасности экстраполяция показателей эффективности и безопасности должна ограничиваться детьми в возрасте 3–5 лет, но не младше 3 лет (см. приложение 3, web–annex 5). Профили воздействия у детей в возрасте 3–5 лет были сопоставимы с профилями взрослых пациентов и не превышали таковые у детей в возрасте от 6 лет, для которых предыдущие ГРР, организованные ВОЗ, ранее рекомендовали применение деламанида (10, 64). По имеющимся лабораторным и кардиологическим данным, у детей в возрасте 3–5 лет не наблюдалось никаких настораживающих признаков, отличных от тех, о которых сообщалось у взрослых. Тем не менее ГРР выразила беспокойство по поводу возможности назначения правильной дозы детям в возрасте 3–5 лет с учетом того, что применявшаяся в ходе испытания специальная дозировка (25 мг) не будет выпускаться в обозримом будущем. Доступной будет только таблетированная форма для взрослых (50 мг), которая не является биоэквивалентной, при этом изменить ее состав без ущерба для эффективности будет проблематичным.
По результатам анализа, проведенного в 2021 г., ГРР заключила, что соотношение между желательными и нежелательными эффектами, вероятно, свидетельствует в пользу применения деламанида у детей младше 3 лет. ГРР 2021 г. также отметила, что при появлении в будущем диспергируемой таблетированной формы с содержанием активного вещества 25 мг ситуация с ресурсами может измениться. Группа предположила, что длительные режимы лечения с деламанидом потенциально способны повысить справедливость и являются приемлемыми для заинтересованных сторон. Кроме того, ГРР 2021 г. сочла, что применение деламанида у детей всех возрастов, вероятно, является осуществимым, в особенности на фоне ожидаемого в 2021 г. появления удобной для детей формы этого препарата (на данный момент она уже доступна). Эксперты также приняли во внимание тот факт, что при разделении, измельчении или растворении предназначенных для взрослых таблеток, чтобы облегчить их применение у детей, биодоступность препаратов может измениться.
По итогам многократного анализа постепенно появлявшихся новых данных ограничение на использование бедаквилина и деламанида в зависимости от возраста пациента больше не применяется.
Таблица 3.1 Распределение по группам препаратов, рекомендуемых для применения в длительных режимах лечения МЛУ-ТБᵃ
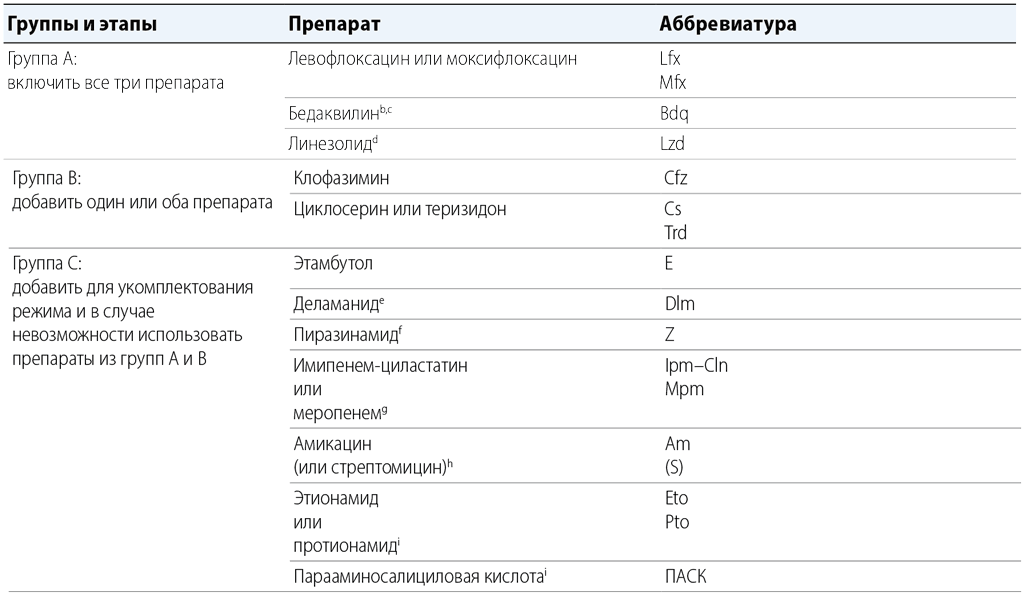
ТЛЧ – тестирование на лекарственную чувствительность; ЭКГ – электрокардиограмма; ГРР – Группа по разработке рекомендаций; ИДП – индивидуальные данные пациентов; LPA – анализ методом молекулярной гибридизации с типоспецифическими зондами; МЛУ-ТБ – ТБ с множественной лекарственной устойчивостью; ТБ – туберкулез.
a Данная таблица предназначена для использования при разработке индивидуальных длительных режимов лечения МЛУ-ТБ (состав рекомендованного короткого режима лечения МЛУ-ТБ в основном стандартизирован; см. раздел 2). Препараты в группе С отсортированы по убыванию стандартной предпочтительности для применения с учетом прочих аспектов. В метаанализе ИДП за 2018 г., посвященном длительным режимам, отсутствовали пациенты, принимавшие тиоацетазон, а также присутствовало слишком мало пациентов, принимавших гатифлоксацин и высокодозный изониазид, для проведения полноценного анализа. Вынесение рекомендаций в отношении перхлозона, гамма-интерферона или сутезолида оказалось невозможным ввиду отсутствия в соответствующих исследованиях данных об итоговых результатах лечения пациентов (см. веб-приложение 5).
b Бедаквилин обычно принимается перорально в дозировке 400 мг один раз в сутки на протяжении первых 2 недель, а затем перорально в дозировке 200 мг три раза в неделю в течение 22 недель (общая продолжительность приема составляет 24 недели). По итогам многократного анализа постепенно появлявшихся новых данных ограничение на использование бедаквилина в зависимости от возраста пациента больше не применяется. В 2018 г. данных о безопасности и эффективности использования бедаквилина на протяжении более чем 6 месяцев оказалось недостаточно для анализа. Таким образом, применение бедаквилина на протяжении более чем 6 месяцев было включено в режим в соответствии с передовой практикой применения препаратов по незарегистрированным показаниям (65). ГРР 2019 г. получила новые фактические данные относительно профиля безопасности применения бедаквилина на протяжении более чем 6 месяцев, но в связи с ограниченным объемом и потенциальным остаточным искажением данных группа не смогла оценить воздействие продолжительного приема бедаквилина на эффективность лечения. В то же время имеющиеся фактические данные свидетельствуют о безопасности применения бедаквилина на протяжении срока, превышающего 6 месяцев, у пациентов, чье состояние было предметом регулярного и надлежащего мониторинга как на базовом этапе, так и в период последующего наблюдения. Прием бедаквилина в течение более чем 6 месяцев по-прежнему представляет собой прием по незарегистрированным показаниям, в связи с чем при подобных назначениях следует руководствоваться передовым опытом в этой области.
c Данных об одновременном применении бедаквилина и деламанида в 2018 г. оказалось недостаточно для анализа. В 2019 г. ГРР получила новые данные об одновременном использовании бедаквилина и деламанида. В отношении безопасности ГРР пришла к выводу о том, что эти данные не содержат каких-либо дополнительных сомнений в безопасности одновременного применения бедаквилина и деламанида. Оба препарата могут применяться одновременно у пациентов, для которых ограничено использование других вариантов лечения, при условии осуществления достаточного мониторинга лечения (включая исходное и последующее снятие ЭКГ и контроль баланса электролитов). ГРР проанализировала данные об эффективности одновременного применения бедаквилина и деламанида, но в связи с ограниченным объемом и потенциальным остаточным искажением данных не смогла вынести рекомендации относительно эффективности такого применения.
d Было обнаружено, что применение линезолида на протяжении не менее чем 6 месяцев повышает эффективность лечения, хотя использование этого препарата может быть ограниченным ввиду его токсичности. Анализ показал, что использование линезолида в течение всего срока лечения позволит оптимизировать его эффект (около 70% пациентов, по которым имелись данные, принимали линезолид на протяжении более чем 6 месяцев, а 30% – на протяжении 18 месяцев или всего курса лечения). Из субанализа ИДП оказалось невозможным вывести какие-либо прогностические признаки для пациентов, связанные с ранним прекращением приема линезолида.
e Данных о безопасности и эффективности использования деламанида на протяжении более чем 6 месяцев оказалось недостаточно для анализа. Применение деламанида подобным образом должно соответствовать передовой практике применения препаратов по незарегистрированным показаниям (65). По итогам многократного анализа постепенно появлявшихся новых данных ограничение на использование деламанида в зависимости от возраста пациента больше не применяется.
f Пиразинамид рассматривается как эффективный препарат только в том случае, если чувствительность к нему подтверждена результатами ТЛЧ.
g Каждую дозу имипенем–циластатина и меропенема применяют вместе с клавулановой кислотой, которая доступна только в препаратах в сочетании с амоксициллином. Амоксициллин-клавулановая кислота не считается дополнительным эффективным противотуберкулезным препаратом и не должна использоваться без имипенем–циластатина или меропенема.
h Амикацин и стрептомицин следует рассматривать только в том случае, если чувствительность к ним подтверждена результатами ТЛЧ и существует возможность обеспечить высококачественный аудиометрический контроль потери слуха. Стрептомицин следует рассматривать только в случае невозможности использования амикацина (т. е. если препарат недоступен или задокументирована устойчивость к нему) и если результаты ТЛЧ подтверждают чувствительность к нему (т. е. устойчивость к стрептомицину не обнаруживается с помощью молекулярных LPA для препаратов второго ряда, поэтому требуется фенотипическое ТЛЧ). Канамицин и капреомицин более не рекомендуются для использования в режимах лечения МЛУ-ТБ.
i Эти препараты продемонстрировали эффективность только в режимах без применения бедаквилина, линезолида, клофазимина или деламанида и поэтому могут быть предложены только при невозможности составления режима из других препаратов.
Таблица 3.2 Относительный риск неуспешного лечения или рецидива и летального исхода (в противоположность успешному лечению). Метаанализ ИДП за 2018 г. по длительным режимам лечения МЛУ-ТБ и клиническое исследование № 213 по деламаниду (популяция с назначенным лечением)ᵃ
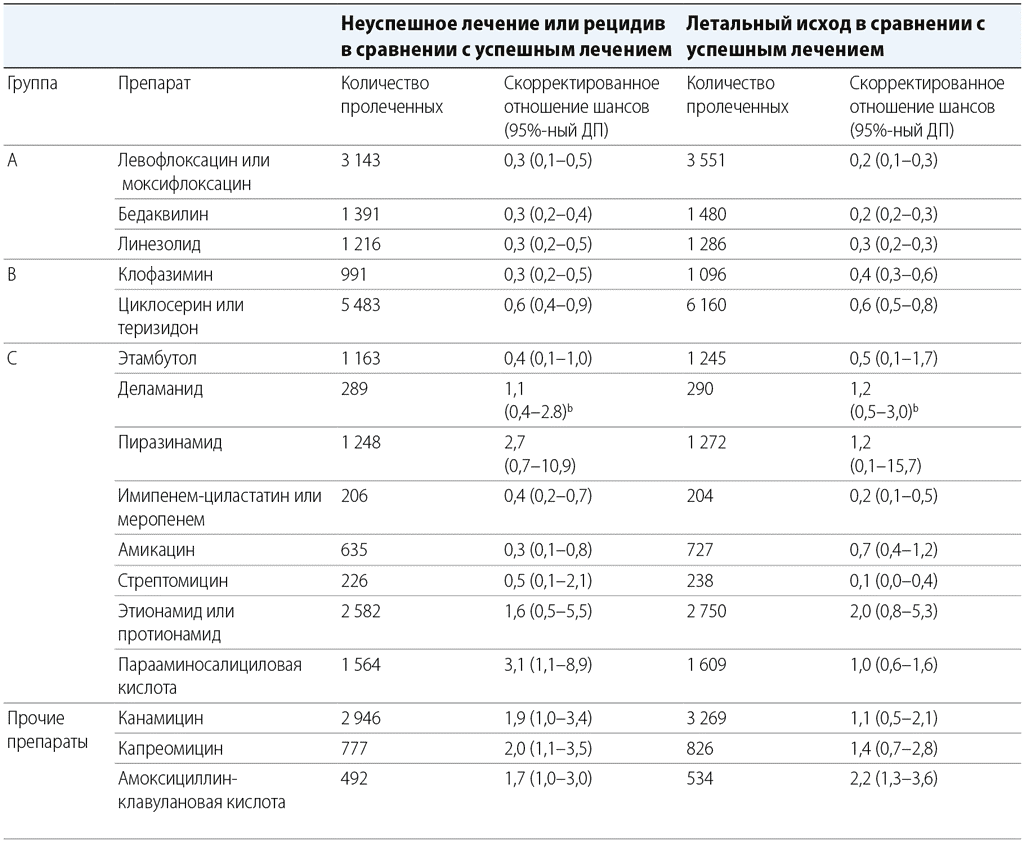
ДП – доверительный предел; ГРР – Группа по разработке рекомендаций; ИДП – индивидуальные данные пациентов; МЛУ-ТБ – туберкулез с множественной лекарственной устойчивостью.
a Более подробную информацию о методах расчета оценок и дополнительных факторах, учтенных ГРР при переклассификации препаратов для использования в длительных режимах лечения МЛУ-ТБ, показанных в таблице 3.1, см. также в тексте руководства, таблице 3.3 и веб-приложениях 3, 4 и 5.
b Отмеченные значения представляют собой нескорректированные коэффициенты риска, определенные авторами исследования № 213 по состоянию на 24-й месяц лечения.
Вопрос PICO № 4–2018 (МЛУ/РУ-ТБ, 2018 г.) (вероятное количество эффективных препаратов)
В отношении вопроса PICO № 4–2018 (МЛУ/РУ-ТБ, 2018 г.) анализ показал, что в длительных режимах лечения МЛУ-ТБ риск неуспешного лечения, рецидива и летального исхода сопоставим в тех случаях, когда лечение начинается с четырех, пяти или шести препаратов с вероятной эффективностью. Анализ также показал, что у пациентов, которые принимали на поддерживающем этапе три препарата (ожидаемая ситуация при четырех препаратах в начале лечения и отмене инъекционного препарата в конце интенсивного этапа), результаты оказались не хуже, чем у пациентов, принимавших на поддерживающем этапе четыре препарата.
Учитывая, что масштаб межлекарственных взаимодействий, суточное количество принимаемых таблеток и вероятность возникновения нежелательных реакций увеличиваются пропорционально количеству препаратов в режиме, желательно назначать пациентам минимальное количество препаратов, необходимых для получения сопоставимых уровней безрецидивного излечения. Принимая решение о минимальном рекомендованном количестве препаратов, ГРР 2018 г. рассматривала анализы, в которых частью режима являлись инъекционные препараты, при этом полностью отдавая себе отчет в том, что, по имеющимся ожиданиям, в будущем присутствие инъекционных препаратов в длительных режимах продолжит сокращаться. Помимо этого, важно было предусмотреть ситуации, в которых на каком-либо этапе лечения происходит отмена более чем одного препарата – либо по показаниям к применению (в соответствии с инструкцией бедаквилин и деламанид обычно отменяют по истечении 6 месяцев), либо вследствие проблем с переносимостью (в особенной степени это относится к линезолиду; см. таблицу 3.3) (66).
Таблица 3.3 Серьезные нежелательные реакции у пациентов, находящихся на длительных режимах лечения МЛУ-ТБᵃ
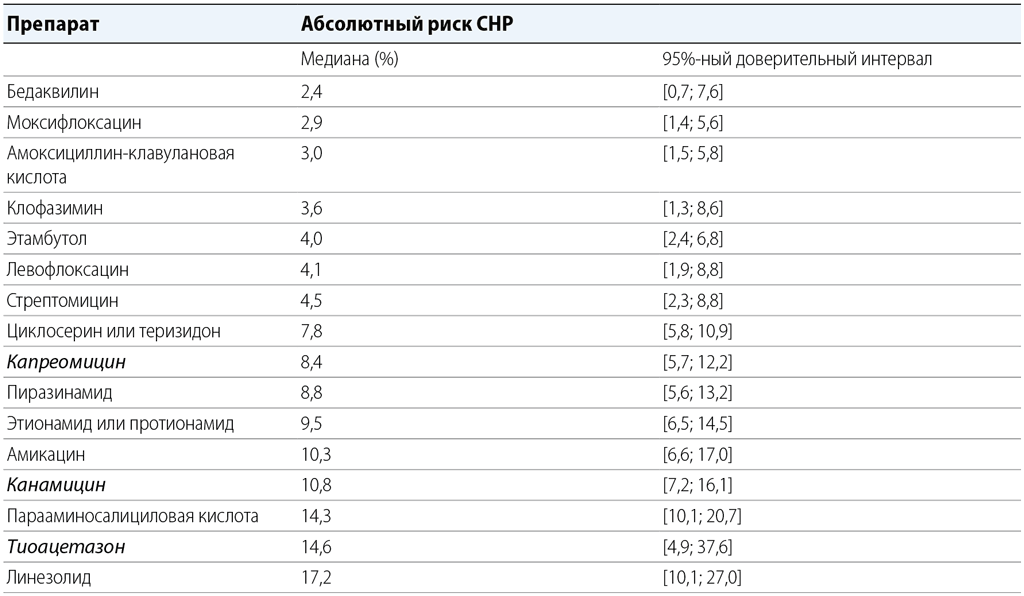
ГРР – Группа по разработке рекомендаций; ИДП – индивидуальные данные пациентов; МЛУ-ТБ – ТБ с множественной лекарственной устойчивостью; ТБ – туберкулез.
a Данные группового сетевого метаанализа подмножества пациентов из ИДП за 2016 г., у которых нежелательные реакции привели к полному прекращению лечения ТБ (27 исследований) или были классифицированы как уровни 3–5 (3 исследования). Существуют незначительные различия между окончательными оценками, приведенными в итоговой статье (66), и значениями, полученными в период работы ГРР и приведенными в данной таблице, поскольку для статьи использовался расширенный массив данных. Тем не менее эти незначительные различия не влияют на выводы, сделанные в отношении применения данных препаратов. Количество записей по деламаниду, имипенем- циластатину и меропенему было недостаточным для оценки рисков. Препараты, не входящие в группы A, B или C, выделены курсивом.
Это означает, что в своей основной части режим будет содержать на два важнейших препарата меньше, чем в начале лечения. Хотя применение бедаквилина на протяжении более чем 6 месяцев по-прежнему рассматривается как применение по незарегистрированным показаниям, ГРР 2019 г. получила новые фактические данные относительно профиля безопасности применения бедаквилина на протяжении более чем 6 месяцев. Эти данные свидетельствуют о безопасности применения бедаквилина на протяжении срока, превышающего 6 месяцев, у пациентов, чье состояние было предметом регулярного и надлежащего мониторинга как на базовом этапе, так и в период последующего наблюдения. Применение бедаквилина на протяжении более чем 6 месяцев по-прежнему рассматривается как применение по незарегистрированным показаниям и поэтому должно соответствовать передовой практике в этой области.
Тем не менее в ИДП за 2018 г. были включены данные по более чем 300 пациентам, принимавшим линезолид по крайней мере в течение 1 месяца в основном в дозировке 600 мг/сут, с информацией о продолжительности приема. Около 30% от этого количества принимали линезолид лишь на протяжении 1–6 месяцев, однако более 30% – на протяжении более чем 18 месяцев, и у последней группы отмечались самые низкие показатели неуспешного лечения, потери для последующего наблюдения и летальных исходов. Отразив на диаграмме продолжительность приема линезолида и показатели неуспешного лечения, можно сделать вывод о том, что оптимальная продолжительность применения этого препарата составляет около 20 месяцев, что соответствует обычной общей продолжительности длительного режима лечения МЛУ-ТБ. Тем не менее подобный анализ не принимает во внимание смещение по выживаемости, означающее, что завершившие полный курс лечения пациенты с большей вероятностью продемонстрируют успешный результат, – с учетом того, что летальные исходы и потеря для последующего наблюдения происходят раньше. ГРР не удалось четко проследить соответствия между типами нежелательных реакций и продолжительностью приема, несмотря на сообщения о нескольких случаях оптической нейропатии, которая, как известно, связана с длительным использованием линезолида (67). В то же время сообщения о гематологической токсичности не зависели от продолжительности применения препарата.
В 2018 г. ГРР рекомендовала по возможности составлять режимы на основе всех трех препаратов группы А и по меньшей мере одного препарата группы В, с тем чтобы лечение начиналось по крайней мере с четырех препаратов с вероятной эффективностью, а в случае прекращения приема бедаквилина по истечении 6 месяцев оставшаяся часть курса лечения состояла бы как минимум из трех препаратов. ГРР 2019 г. получила новые фактические данные о показателях безопасности бедаквилина при его приеме в течение более чем 6 месяцев. Эти данные подтверждают безопасность применения бедаквилина на протяжении более чем 6 месяцев у пациентов, соблюдающих соответствующий график исходного и последующего мониторинга лечения. В случае возможности применения только одного или двух препаратов группы A в режим следует включить оба препарата группы B. Если режим не может быть составлен только из препаратов групп A и B, их необходимо дополнить препаратами группы C. Пациентам с высокой вероятностью отмены двух препаратов группы А до конца лечения (например, если риски для здоровья вследствие существующих сопутствующих патологий требуют ранней отмены как бедаквилина, так и линезолида) может быть целесообразно начинать лечение не с четырех, а с пяти эффективных препаратов. Ожидается, что вышеуказанные положения будут применяться к большинству пациентов с МЛУ/РУ-ТБ, в том числе к пациентам, имеющим дополнительную устойчивость к фторхинолонам или другим препаратам.
Вопрос PICO № 8–2019 (МЛУ/РУ-ТБ, 2019 г.) (применение бедаквилина на протяжении более чем 6 месяцев)
В отношении вопроса PICO № 8–2019 (МЛУ/РУ-ТБ, 2019 г.) анализ показал СОШ, равные 1,5 (95%-ный ДИ = 0,7–2,7) между успехом и неуспехом лечения; 0,8 (95%-ный ДИ = 0,2– 0,4) между успехом лечения и летальным исходом; 1,0 (95%-ный ДИ = 0,5–1,7) между успехом и неуспехом лечения или летальным исходом; 0,8 (95%-ный ДИ = 0,5–1,2) между успехом лечения и всеми неблагоприятными исходами. Чтобы свести к минимуму искажения, эксперты-рецензенты запланировали использование двух аналитических подходов – предельные структурные модели для учета изменяющихся во времени искажений, а также отбор подобного по вероятности в отношении характеристик пациентов. Однако размер выборки наложил ограничения на способы применения первого подхода. Кроме того, в связи с ограничениями массива данных специалисты по биостатистике сообщили о невозможности внести поправки на искажения, предусмотренные изначальным планом анализа данных. ГРР 2019 г. отметила, что популяция, включенная в анализируемое исследование, представляла собой тщательно отобранную группу с возможностью искажения показателей (т. е. прием бедаквилина в течение > 6 месяцев с большой вероятностью был обусловлен наличием клинических факторов, при которых показано длительное лечение бедаквилином). ГРР пришла к заключению о существовании высокой вероятности остаточного искажения данных и о том, что данные проанализированной в рамках исследования группы пациентов не могут быть экстраполированы для планового применения у всех пациентов с МЛУ/РУ-ТБ. В связи с этим ГРР 2019 г. не смогла вынести официальную рекомендацию относительно эффективности или действенности применения бедаквилина на протяжении более чем 6 месяцев; тем не менее группа сочла возможным выступить с заявлением о его безопасности. Эта информация включена в раздел 3.5 и в примечании к таблице 3.1.
Что касается нежелательных реакций, то из 750 пациентов – участников обсервационного исследования endTB, принимавших бедаквилин без одновременного приема деламанида (общая экспозиция = 6316 человеко-месяцев), у 26 пациентов возникли связанные с данным препаратом нежелательные реакции (частота возникновения = 0,44 на 100 человекомесяцев экспозиции), причем у 16 пациентов эти реакции были классифицированы как серьезная нежелательная реакция (частота возникновения = 0,25 на 100 человеко-месяцев экспозиции). 20 из 26 нежелательных реакций и 15 из 16 серьезных нежелательных реакций, связанных с препаратом, возникли в первые 203 суток приема бедаквилина (общая экспозиция = 4304 человеко-месяца); оставшиеся 6 из 26 нежелательных реакций и 1 из 16 серьезных нежелательных реакций, связанных с препаратом, возникли позднее. Все пациенты, принимавшие бедаквилин на протяжении более чем 203 суток, не испытывали связанных с препаратом нежелательных реакций (любой степени тяжести) в течение первых 203 суток лечения. Кроме того, по истечении первых 203 суток лечения частота возникновения связанных с препаратом нежелательных реакций оказалась ниже и составила 0,51 в первые 203 суток лечения по сравнению с 0,30 в последующие дни (в расчете на 100 человеко-месяцев). Аналогичным образом обнаружилось, что частота возникновения связанных с препаратом серьезных нежелательных реакций по истечении первых 203 суток лечения оказалась ниже: 0,35 в первые 203 суток лечения по сравнению с 0,05 в последующие дни (в расчете на 100 человеко-месяцев).
Значение интервала QTcF у пациентов, принимавших бедаквилин, увеличилось в среднем на 22 мс (с 397 до 419 мс) при сравнении измерений, сделанных в момент первого приема бедаквилина или до него и в конце первого месяца лечения. При измерениях в течение следующих месяцев приема препарата все средние значения интервала QTcF были ниже, чем в конце первого месяца лечения (в диапазоне от 404 до 419 мс). Увеличение интервала QTcF более чем на 60 мс от исходного значения было зафиксировано примерно у 12% пациентов. Удлинение интервала QTcF более чем на 500 мс встречалось редко – у 0,4–1,5% пациентов в течение каждого из первых 9 месяцев лечения, но не позже этого срока. Наибольшее количество случаев увеличения интервала QTcF более чем на 500 мс наблюдалось у пациентов, принимавших бедаквилин и клофазимин; вместе с тем подобная комбинация препаратов относилась к наиболее распространенным.
Связанные с препаратами кардиологические нежелательные реакции были отмечены у 22 человек; из них 15 реакций были зафиксированы у пациентов, принимавших бедаквилин с клофазимином, но не моксифлоксацин или деламанид (частота возникновения = 0,3 на 100 человеко-месяцев), 5 – у пациентов, принимавших бедаквилин с клофазимином и моксифлоксацином, но не деламанид (частота возникновения = 0,3 на 100 человекомесяцев), а 2 – у пациентов, принимавших бедаквилин и деламанид вне зависимости от приема клофазимина и моксифлоксацина (частота возникновения = 0,2 на 100 человекомесяцев). У пациентов, принимавших бедаквилин без клофазимина, моксифлоксацина и деламанида, нежелательных реакций отмечено не было.
Что касается приема бедаквилина во время беременности, то при сравнении младенцев, подвергавшихся и не подвергавшихся воздействию бедаквилина во внутриутробном периоде, когортное исследование не выявило статистически значимых различий между исходами родов или беременности (Р = 0,741 для исходов родов и Р = 0,312 для исходов беременности) (51). В группе, подвергавшейся воздействию бедаквилина, было зарегистрировано 45 живорождений (92% от общего числа) против 54 живорождений (90% от общего числа) в группе, не подвергавшейся воздействию бедаквилина. Кроме того, в группе младенцев, подвергавшихся воздействию бедаквилина, было зарегистрировано четыре случая смерти плода или новорожденного (8% от общего размера группы, подвергавшейся воздействию бедаквилина: три мертворождения и одно прерывание беременности), а в группе, не подвергавшейся воздействию бедаквилина, – шесть случаев смерти плода или новорожденного (10% от общей группы, не подвергавшейся воздействию: три мертворождения и три самопроизвольных аборта) (51). Результаты исследования также показали большее количество положительных исходов лечения у беременных женщин, подвергавшихся воздействию бедаквилина, по сравнению с не подвергавшимися такому воздействию (71% против 62% соответственно, Р = 0,349) (51). Исходы беременности включали в себя живорождение и неблагоприятные исходы (смерть плода или новорожденного, преждевременные роды на сроке < 37 недель и низкая масса тела при рождении на уровне < 2500 г), а оценка состояния здоровья младенцев включала в себя набор массы тела и основные этапы развития, а также диагностирование ТБ (51). Среди всех прошедших оценку исходов беременности и состояний здоровья младенца с внутриутробным воздействием бедаквилина оказалась связана только низкая масса тела при рождении (45% по сравнению с 26%, P = 0,034). В среднем масса тела младенцев, подвергавшихся воздействию бедаквилина, составила 2690 г по сравнению с 2900 г у младенцев, не подвергавшихся такому воздействию. Тем не менее установить окончательную связь между подобным эффектом и бедаквилином не удалось; для изучения этой взаимосвязи необходимы дополнительные исследования (51). В отношении роста младенцев после рождения значительных различий выявлено не было: по результатам субанализа показателей 86 младенцев (41 из них подвергался, а 45 – не подвергались воздействию бедаквилина), за которыми было организовано плановое последующее наблюдение, нормальный набор массы тела в возрасте 1 года был зафиксирован у 88% младенцев, подвергавшихся внутриутробному воздействию бедаквилина, и у 82% младенцев, не подвергавшихся такому воздействию (P = 0,914) (51).
Вопрос PICO № 9–2019 (МЛУ/РУ-ТБ, 2019 г.) (совместное применение бедаквилина и деламанида)
В отношении вопроса PICO № 9–2019 (МЛУ/РУ-ТБ, 2019 г.) анализ показал СОШ, равные 1,6 (95%-ный ДИ = 0,5–5,4) между успехом и неуспехом лечения; 0,8 (95%-ный ДИ = 0,3–2,1) между успехом лечения и летальным исходом; 1,2 (95%-ный ДИ = 0,6–2,5) между успехом и неуспехом лечения или летальным исходом; 0,6 (95%-ный ДИ = 0,3–1,1) между успехом лечения и всеми неблагоприятными исходами. Что касается нежелательных реакций, то у 92 пациентов – участников обсервационного исследования endTB, получавших бедаквилин и деламанид одновременно (общая экспозиция = 1095 человеко-месяцев), были отмечены две нежелательные реакции, связанные с бедаквилином и деламанидом (суммарная частота возникновения = 0,46 на 100 человеко-месяцев экспозиции). Этот показатель был сопоставим с показателями пациентов, принимавших только бедаквилин (0,41 на 100 человеко-месяцев экспозиции) и только деламанид (0,68 на 100 человеко-месяцев экспозиции). У 92 пациентов, получавших бедаквилин и деламанид одновременно, были отмечены две нежелательные реакции, связанные с препаратами, – по одному случаю на каждый препарат (суммарная частота возникновения = 0,09 на 100 человеко-месяцев экспозиции). Частота возникновения этих событий была ниже частоты связанных с препаратами серьезных нежелательных реакций среди пациентов, получавших только один из этих препаратов (бедаквилин = 0,28; деламанид = 0,39). Среди пациентов, получавших бедаквилин и деламанид одновременно, летальные исходы отмечены не были.
Значение интервала QTcF у пациентов, принимавших бедаквилин и деламанид, увеличилось в среднем на 15 мс (с 398 до 413 мс) при сравнении измерений, сделанных в момент первого одновременного приема бедаквилина и деламанида или до него и в конце первого месяца лечения. При измерениях в течение следующих месяцев приема препарата все средние значения интервала QTcF были аналогичны измеренным в конце первого месяца лечения (в диапазоне от 404 до 420 мс). Удлинение интервала QTcF более чем на 500 мс встречалось редко – лишь у одного пациента на седьмом месяце одновременного приема обоих препаратов. Связанные с препаратами кардиологические нежелательные реакции встречались редко – лишь у двух из 92 человек, принимавших бедаквилин и деламанид одновременно (частота возникновения = 0,2 на 100 человеко-месяцев). Также была зарегистрирована только одна связанная с препаратами кардиологическая серьезная нежелательная реакция (частота возникновения = 0,1 на 100 человеко-месяцев). Среди 92 пациентов, получавших бедаквилин и деламанид одновременно, связанные с препаратами кардиологические нежелательные реакции с летальным исходом отмечены не были.
В целом среди участников обсервационного исследования endTB (n = 1094) было зарегистрировано два летальных случая по кардиологическим причинам (внезапная смерть, связанная с удлинением интервала QT); еще у одного пациента была выявлена аритмия сердца. Оба летальных случая относились к пациентам, принимавшим бедаквилин, клофазимин, капреомицин и парааминосалициловую кислоту (но не моксифлоксацин или деламанид); у обоих пациентов наблюдалась гипокалиемия. Эти пациенты не были включены в анализ, связанный с данным вопросом PICO, так как не отвечали критериям включения, определенным в соответствии с заранее составленным планом статистического анализа. Тем не менее, принимая во внимание, что эти оценки серьезных нежелательных реакций являются абсолютными, а не относительными, группа экспертов сочла, что эти дополнительные фактические данные будут представлять важность для тщательного контроля после получения окончательных данных обсервационного исследования endTB.
Поскольку в экспериментальной группе насчитывалось всего 84 пациента, а данные не подлежали полноценному анализу по вторичному сравнительному признаку (длительному приему только деламанида), так как различия между группами были слишком велики для обычного сопоставления, ГРР пришла к выводу о нехватке фактических данных для оценки эффективности и действенности одновременного применения бедаквилина и деламанида. В связи с этим ГРР не смогла вынести официальную рекомендацию относительно эффективности или действенности одновременного применения бедаквилина и деламанида; тем не менее группа сочла возможным выступить с заявлением о его безопасности. Эта информация включена в раздел 3.5 и в примечание к таблице 3.1.
Дополнительные данные клинического испытания DELIBERATE показали, что среди пациентов, рандомизированных по признаку приема бедаквилина (n = 28), деламанида (n = 27) или обоих препаратов (n = 27), изменение интервала QTcF на фоне лечения по сравнению с исходным показателем составило 11,9 мс, 8,6 мс и 20,7 мс соответственно8. Из 27 пациентов, получавших оба препарата, у 10 (37,0%) наблюдалась нежелательная реакция уровня 19 в форме удлинения интервала QT, а у двоих (7,4%) – нежелательная реакция уровня 2 в той же форме. В группе, принимавшей бедаквилин, нежелательные реакции уровня 1 и 2, связанные с удлинением QT, наблюдались соответственно у 32,0% и 3,6% пациентов; в группе, принимавшей деламанид, эти показатели составили 41,0% для нежелательной реакции уровня 1 и 7,4% – для уровня 2. Нежелательные реакции уровней 3 и 4, связанные с удлинением QT, отмечены не были. Исследователи пришли к выводу о том, что воздействие одновременного приема деламанида и бедаквилина на удлинение QTcF не превышает суммарного воздействия этих препаратов по отдельности. ГРР отметила, что в исследовании DELIBERATE связанные с удлинением QT нежелательные реакции выступали суррогатными маркерами внезапной сердечной смерти. Группа также обратила внимание на тот факт, что в ходе исследования DELIBERATE в назначаемые пациентам режимы в качестве препарата фторхинолонового ряда входил левофлоксацин, а уровень калия в сыворотке крови тщательно контролировался.
Вопрос PICO № 1–2021 (ТБ у детей, 2021 г.) (применение бедаквилина у пациентов младше 6 лет с МЛУ/РУ-ТБ) и вопрос PICO № 2–2021 (ТБ у детей, 2021 г.) (применение деламанида у пациентов младше 3 лет с МЛУ/РУ-ТБ)
Подробная информация об анализе фактических данных и обсуждениях ГРР в отношении вопросов PICO №№ 1–2021 и 2–2021 (ТБ у детей, 2021 г.) содержится в документе WHO consolidated guidelines on tuberculosis. Module 5. Management of tuberculosis in children and adolescents [«Сводное руководство ВОЗ по туберкулезу. Модуль 5: ведение туберкулеза у детей и подростков»].
8 Данное заявление и остальная часть абзаца составлены на основании личного сообщения K. Dooley, медицинский факультет Университета Джонса Хопкинса, ноябрь 2019 г.
9 В рамках исследования DELIBERATE нежелательная реакция уровня 1, связанная с удлинением QT, определялась как абсолютное значение QTcF > 480 мс до ≤ 500 мс с изменением QTcF по сравнению с исходным значением на от > 0 мс до ≤ 30 мс ИЛИ как абсолютное значение QTcF ≤ 480 мс с изменением QTcF по сравнению с исходным значением на от > 30 мс до ≤ 60 мс. Нежелательная реакция уровня 2, связанная с удлинением QT, определялась как абсолютное значение QTcF > 480 мс до ≤ 500 мс с изменением QTcF по сравнению с исходным значением на от > 30 мс до ≤ 60 мс ИЛИ как абсолютное значение QTcF ≤ 480 мс с изменением QTcF по сравнению с исходным значением на > 60 мс. Нежелательная реакция уровня 3, связанная с удлинением QT, определялась как абсолютное значение QTcF > 500 мс ИЛИ как абсолютное значение QTcF > 480 мс с изменением QTcF по сравнению с исходным значением на > 60 мс. Нежелательная реакция уровня 4, связанная с удлинением QT, определялась как влекущая за собой угрозу жизни – например, двунаправленную желудочковую тахикардию или другую связанную с этим явлением тяжелую желудочковую аритмию (личное сообщение K. Dooley, медицинский факультет Университета Джонса Хопкинса, ноябрь 2019 г.).
 Обратная связь
Обратная связь