Перекрёстные ссылки книги для 6.2.2 Medicines used in longer MDR-TB treatment regimens
Классификация препаратов, используемых в режимах лечения МЛУ/РУ-ТБ, была пересмотрена после обновления руководства ВОЗ по лечению ЛУ-ТБ в 2018 г. на основании полученных фактических данных. Противотуберкулезные препараты, которые используются для лечения МЛУ/РУ-ТБ, разделены на группы A, B и C (см. таблицу 6.1) (1). При составлении этой классификации учитывались классы препаратов и степень уверенности в фактических данных относительно их эффективности и безопасности (то есть оптимальное соотношение пользы и риска возможного вреда). При анализе рассматривались преимущественно данные о взрослых пациентах, которые получали лечение в рамках этих режимов в последние годы. В группы A–C включены препараты, которые являются составными частями длительных режимов лечения МЛУ-ТБ. ВОЗ считает, что в рамках программных условий только эти препараты (группы A–C) могут использоваться в качестве элементов длительных режимов лечения МЛУ-ТБ. Помимо препаратов, входящих в группы A–C, обсуждается также возможная роль клавулановой кислоты и высокодозного изониазида (см. пункт «Прочие препараты» в данном разделе).
Главные различия между классификацией компонентов длительного режима, использовавшейся до 2018 г., и настоящим руководством заключаются в повышении уровня приоритетности бедаквилина, линезолида, клофазимина и циклосерина/ теризидона, включении деламанида в группу C и снижении уровня приоритетности пиразинамида, амикацина, стрептомицина, этионамида/протионамида и ПАСК по сравнению с другими вариантами лечения. Ряд препаратов, которые ранее фигурировали в этих группах, были исключены по следующим причинам:
- более не рекомендуются (например, офлоксацин, капреомицин и канамицин);
- редко применяются в длительных режимах (например, высокодозный изониазид);
- представляют собой дополнительный препарат, предназначенный для применения только в сочетании с другими лекарственными средствами (например, клавулановая кислота используется только в комбинации с карбапенемами).
Данная классификация призвана помочь в составлении режима лечения для пациентов с ЛУ-ТБ, которым не подходят режимы BPaLM/BPaL или 9-месячные режимы. В таблице 6.1 кратко описываются основные этапы включения препаратов, предназначенных для длительных режимов лечения МЛУ-ТБ, в соответствии с последней редакцией руководства ВОЗ и приводится более подробная информация, включающая примеры наиболее распространенных ситуаций и подгрупп пациентов, с которыми могут столкнуться лечащие врачи и НПТ.
Таблица 6.1. Распределение по группам препаратов, рекомендуемых для применения в длительных режимах лечения МЛУ-ТБa
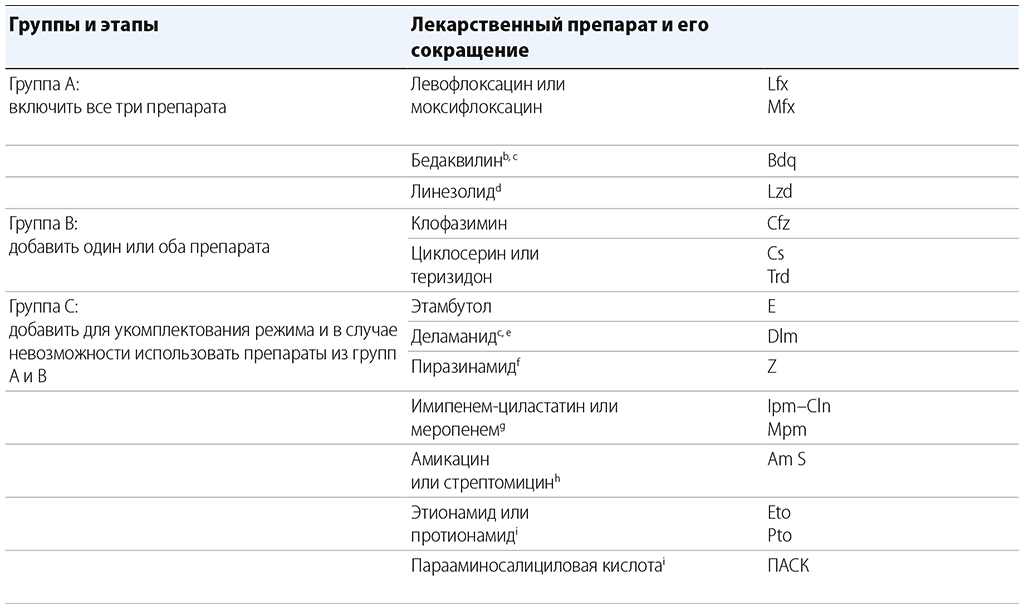
ТЛЧ: тестирование на лекарственную чувствительность; ЭКГ: электрокардиограмма; ГРР: Группа по разработке рекомендаций; ИДП: индивидуальные данные пациентов; LPA: анализ методом молекулярной гибридизации с типоспецифическими зондами; МЛУ-ТБ: ТБ с множественной лекарственной устойчивостью; ТБ: туберкулез.
a Данная таблица предназначена для использования при разработке индивидуальных длительных режимов лечения МЛУ-ТБ. Препараты в группе С отсортированы по убыванию стандартной предпочтительности для применения с учетом прочих аспектов. В метаанализе ИДП за 2018 г., посвященном длительным режимам, отсутствовали пациенты, принимавшие тиоацетазон и высокодозный изониазид, что не позволило провести полноценный анализ. Вынесение рекомендаций в отношении перхлозона, гамма-интерферона или сутезолида оказалось невозможным ввиду отсутствия в соответствующих исследованиях данных об итоговых результатах лечения пациентов (1).
b Бедаквилин обычно принимается перорально в дозировке 400 мг один раз в сутки на протяжении первых 2 недель, а затем перорально в дозировке 200 мг три раза в неделю в течение 22 недель (общая продолжительность приема составляет 24 недели). По итогам многократного анализа постепенно появлявшихся новых данных ограничение на использование бедаквилина в зависимости от возраста пациента больше не применяется. В 2018 г. данных о безопасности и эффективности использования бедаквилина на протяжении более чем 6 месяцев оказалось недостаточно для анализа. Таким образом, применение бедаквилина на протяжении более чем 6 месяцев было включено в режим в соответствиис передовой практикой применения препаратов по незарегистрированным показаниям (66). В 2019 г. ГРР получила новые фактические данные относительно профиля безопасности применения бедаквилина на протяжении более чем 6 месяцев, но в связи с ограниченным объемом и потенциальным остаточным искажением данных группа не смогла оценить воздействие продолжительного приема бедаквилина на эффективность лечения. В то же время имеющиеся фактические данные свидетельствуют о безопасности применения бедаквилина на протяжении срока, превышающего 6 месяцев, у пациентов, чье состояние было предметом регулярного и надлежащего мониторинга как на базовом этапе, так и в период последующего наблюдения. Прием бедаквилина в течение более чем 6 месяцев по-прежнему представляет собой прием по незарегистрированным показаниям, в связи с чем при подобных назначениях следует руководствоваться передовым опытом в этой области.
c Данных об одновременном применении бедаквилина и деламанида в 2018 г. оказалось недостаточно для анализа. В 2019 г. ГРР получила новые данные о безопасности и эффективности одновременного использования бедаквилина и деламанида. Что касается безопасности, ГРР пришла к выводу о том, что имеющиеся данные не указывают на наличие дополнительных рисков, связанных с одновременным приемом бедаквилина и деламанида. В период с 2020 по 2022 г. появились новые данные по этой теме (67). Допускается одновременное назначение обоих препаратов пациентам, у которых ограничен выбор других вариантов лечения, при условии обеспечения надлежащего мониторинга (включая проведение ЭКГ на базовом этапе и при последующем наблюдении и мониторинг уровня электролитов). В 2019 г. ГРР проанализировала данные об эффективности одновременного применения бедаквилина и деламанида, но не смогла выработать какую-либо соответствующую рекомендацию по причине недостаточного объема фактических данных и возможного остаточного искажения информации (1).
d Было обнаружено, что применение линезолида на протяжении не менее чем 6 месяцев повышает эффективность лечения, хотя использование этого препарата может быть ограниченным ввиду его токсичности. Анализ показал, что использование линезолида в течение всего срока лечения позволит оптимизировать его эффект (около 70% пациентов, по которым имелись данные, принимали линезолид на протяжении более чем 6 месяцев, а 30% – на протяжении 18 месяцев или всего курса лечения). Из субанализа ИДП оказалось невозможным вывести какие-либо прогностические признаки для пациентов, связанные с ранним прекращением приема линезолида.
e Данных о безопасности и эффективности использования деламанида на протяжении более чем 6 месяцев оказалось недостаточно для анализа. Применение деламанида подобным образом должно соответствовать передовой практике применения препаратов по незарегистрированным показаниям (66). По итогам многократного анализа постепенно появлявшихся в течение нескольких лет новых данных ограничение на использование деламанида в зависимости от возраста пациента больше не применяется.
f Пиразинамид рассматривается как эффективный препарат только в том случае, когда чувствительность к нему подтверждена результатами ТЛЧ.
g За 30–60 минут до каждого приема имипенем–циластатина или меропенема следует перорально принимать дозу клавулановой кислоты, которая доступна только в препаратах в сочетании с амоксициллином. Амоксициллин-клавулановая кислота не считается дополнительным эффективным противотуберкулезным препаратом и не должна использоваться без имипенем–циластатина или меропенема.
h Амикацин и стрептомицин следует рассматривать только в том случае, если чувствительность к ним подтверждена результатами ТЛЧ и существует возможность обеспечить высококачественный аудиометрический контроль потери слуха. Стрептомицин следует рассматривать только в случае невозможности использования амикацина (препарат недоступен или задокументирована устойчивость к нему) и если результаты ТЛЧ подтверждают чувствительность к нему (устойчивость к стрептомицину не обнаруживается с помощью молекулярных LPA для препаратов второго ряда, поэтому требуется фенотипическое ТЛЧ). Канамицин и капреомицин более не рекомендуются для использования в режимах лечения МЛУ-ТБ.
i Эти препараты продемонстрировали эффективность только в режимах без применения бедаквилина, линезолида, клофазимина или деламанида и поэтому могут быть предложены только если другие варианты составления режима невозможны.
руппа A
Группа А включает в себя фторхинолоны (левофлоксацин и моксифлоксацин), бедаквилин и линезолид. Согласно анализу фактических данных, который проводился в 2018 г. в рамках подготовки руководства ВОЗ (1), эти препараты отличаются высокой эффективностью, значительно улучшая результаты лечения и снижая показатели смертности, в связи с чем настоятельно рекомендуется включать их во все длительные режимы лечения МЛУ-ТБ и назначать всем пациентам с МЛУ/РУ-ТБ, у которых есть показания для назначения таких режимов, за исключением случаев токсичности препаратов или лекарственной устойчивости.
Левофлоксацин и моксифлоксацин
Левофлоксацин и моксифлоксацин являются фторхинолонами последнего поколения, и их применение в рамках метаанализа, который лег в основу руководства ВОЗ (обновленная редакция от 2018 г.), позволило значительно снизить риск неэффективного лечения, а также рецидива заболевания и смерти пациентов (1, 11, 68, 69). Вероятно, левофлоксацин и моксифлоксацин одинаково эффективны в длительных режимах у пациентов с чувствительностью к фторхинолонам и любой из этих препаратов может быть рекомендован в качестве компонентов этих режимов лечения МЛУ/РУ-ТБ. Ципрофлоксацин и офлоксацин, напротив, более не рекомендуются при МЛУ-ТБ по причине более низкой эффективности.
Для левофлоксацина и моксифлоксацина существуют надежные быстрые молекулярные ТЛЧ (в том числе Xpert MTB/XDR и LPA к препаратам второго ряда). Не все точечные мутации имеют одинаковый характер устойчивости. Некоторые мутации (например, gyrA D94N или D94Y) последовательно демонстрируют высокий уровень минимальной ингибирующей концентрации (МИК), тогда как большинство мутаций характеризуются широким спектром фенотипической устойчивости, которая может превышать уровни критической концентрации (КК) и клинического предела (КП). Следовательно, после того как устойчивость к фторхинолонам будет выявлена молекулярными методами и начнется курс лечения, в качестве эталонного теста для определения различий между мутациями, приводящими к появлению устойчивости высокого (> КП) и низкого (> КК и < КП) уровня, и возможного назначения высокодозных фторхинолонов может использоваться фенотипический метод. При обнаружении этих мутаций следует пересмотреть состав длительного режима, опираясь на результаты фенотипического ТЛЧ на КП (70).
В случае если ТЛЧ к моксифлоксацину подтверждает наличие устойчивости высокого уровня или анамнез лечения позволяет сделать выводы о неэффективности этого препарата (например, если режим лечения, в рамках которого моксифлоксацин принимался на протяжении более чем 15–30 дней, оказался неэффективным), его прием не рекомендуется. Продолжается работа по оптимизации использования моксифлоксацина, затрагивающая вопросы секвенирования, КК для фенотипического ТЛЧ и сопоставления с другими клиническими данными (70–72).
Бедаквилин
Согласно результатам метаанализа ИДП, который лег в основу руководства ВОЗ, при применении бедаквилина наблюдалось значительно меньшее число случаев неэффективного лечения, рецидивов и летальных исходов (1). Сегодня появляется все больше данных о применении этого препарата для лечения детей, подростков, пожилых людей, пациентов с внелегочным ТБ и ЛЖВ (73, 74). В настоящее время возрастные ограничения для применения бедаквилина, в том числе в длительных режимах, отсутствуют (47).
Анализ данных, полученных из обсервационных исследований, показал, что доля выживаемости среди пациентов, получавших бедаквилин в рамках своих режимов лечения (47), оказалась выше и что бедаквилин демонстрирует высокие показатели безопасности при одновременном приеме с другими противотуберкулезными препаратами, включая лекарства, способствующие удлинению интервала QT (например, моксифлоксацин, клофазимин и деламанид) (75–80). Анализ последних данных, полученных при подготовке сводного руководства ВОЗ (1), не предполагает дополнительных опасений по поводу безопасности при приеме бедаквилина в течение срока, превышающего 6 месяцев, одновременно с деламанидом или во время беременности (77). Имеющиеся данные указывают на то, что одновременный прием бедаквилина и деламанида не повышает риск клинически значимого удлинения интервала QT (81).
Появляется ряд неубедительных фактических данных: так, некоторые опубликованные данные о стремительном развитии устойчивости к бедаквилину в условиях, где он применяется, могут указывать на то, что бедаквилин относится к препаратам с низким генетическим барьером (т. е. устойчивость к нему может возникать быстро) в результате частых естественных мутаций. Кроме того, следует учитывать длительный период полувыведения (5,5 месяца), благодаря которому у пациентов, потерянных для последующего наблюдения, бедаквилин может действовать как препарат монотерапии. Для предотвращения развития устойчивости к бедаквилину необходимо проводить тестирование на устойчивость к фторхинолонам и по возможности отслеживать уровень устойчивости. При мутации в генах Rv0678 (которая приводит к положительной регуляции эффлюксной помпы) и pepQ бедаквилин будет иметь перекрестную устойчивость с клофазимином. Устойчивость может возникать спонтанно, даже в отсутствие предшествующего приема бедаквилина или клофазимина (по данным некоторых исследований – в 4,1% случаев) (82, 83). Мутации в гене atp-E могут вызвать высокий уровень устойчивости к бедаквилину.
Линезолид
Противотуберкулезные свойства линезолида были подтверждены как in vitro, так и в ходе испытаний на животных, а его эффективность при лечении людей была доказана в рамках метаанализа, проводившегося при подготовке сводного руководства ВОЗ, и во время недавних испытаний с участием пациентов с ШЛУ-ТБ (1, 84–88).
Линезолид обладает значительной токсичностью, что делает необходимым тщательный мониторинг признаков миелосупрессии и различных форм нейропатии. Данные метаанализа ИДП за 2018 г., которые легли в основу руководства ВОЗ, включали информацию о более чем 300 пациентах, которые получали линезолид в течение как минимум 1 месяца (большинство в дозировке 600 мг/сут). Около 30% пациентов получали линезолид лишь на протяжении 1–6 месяцев, но более 30% – на протяжении более 18 месяцев, и у последней группы отмечались самые низкие показатели неэффективного лечения, потери для последующего наблюдения и летальных исходов. Данный анализ позволяет прийти к выводу о том, что оптимальная продолжительность применения этого препарата составляет около 20 месяцев, что соответствует обычной общей продолжительности длительного режима лечения МЛУ-ТБ, хотя подобный анализ не учитывает смещение по выживаемости (означающее, что завершившие полный курс лечения пациенты с большей вероятностью продемонстрируют успешный результат, учитывая, что летальные исходы и потери для последующего наблюдения происходят раньше) (1, 89).
Данные сводного руководства ВОЗ (1) предполагают, что линезолид следует использовать до тех пор, пока он переносится. Применение линезолида на протяжении всего срока лечения способствует улучшению результатов лечения. Однако наибольшая дополнительная эффективность (в том числе предотвращение приобретенной лекарственной устойчивости к другим препаратам второго ряда), вероятно, наблюдается в течение первых месяцев лечения, когда бактериальная нагрузка является наиболее высокой (90). При возникновении токсичности дозу линезолида следует снизить или заменить его другим бактерицидным препаратом (17).
Линезолид не подвергается воздействию цитохрома р450 и не метаболизируется им; при этом он является ингибитором моноаминоксидазы и в этом качестве вызывает повышение уровня серотонина и тирамина. При совместном применении линезолида с другими ингибиторами моноаминоксидазы, которые часто используются в клинической практике у пациентов с ТБ (например, с антидепрессантами, опиоидными обезболивающими, такими как трамадол, противопростудными или противокашлевыми средствами, например декстрометорфаном), может возникнуть серотонинергический синдром, который представляет собой серьезное и угрожающее жизни состояние (91).
Группа В
Группа В включает клофазимин и циклосерин или теризидон, которые, согласно результатам анализа фактических данных при подготовке руководства ВОЗ в 2018 г., способствовали улучшению результатов лечения, однако оказались недостаточно эффективными в вопросах снижения числа летальных исходов (1). Допускается включение как одного, так и обоих препаратов, с тем чтобы гарантировать, что длительный режим начинается как минимум с четырех эффективных лекарственных средств.
Клофазимин
Клофазимин является противолепрозным лекарственным средством с доказанной бактерицидной активностью в отношении М. tuberculosis и на протяжении нескольких лет используется в качестве противотуберкулезного препарата второго ряда. Результаты метаанализа, проводившегося при подготовке сводного руководства ВОЗ, еще раз подтвердили фактические данные, свидетельствующие об эффективности и показателях безопасности клофазимина (1). При одновременном использовании с препаратами, удлиняющими интервал QT (такими как бедаквилин, фторхинолоны и деламанид), клофазимин способен вызвать дополнительное удлинение интервала QT. В случае одновременного приема с бедаквилином или если в число компонентов режима лечения входит несколько препаратов, удлиняющих интервал QT, требуется проводить мониторинг ЭКГ. По возможности следует также избегать приема других препаратов, которые удлиняют интервал QT и при этом не относятся к числу противотуберкулезных.
В число распространенных нежелательных реакций, связанных с приемом клофазимина, входят окрашивание в багрово-красный или оранжевый цвет кожи, слизистой и роговой оболочки глаз и биологических жидкостей организма; сухость кожи, зуд, сыпь, ихтиоз и ксероз; желудочно-кишечная непереносимость; фотосенсибилизация. Пациентов с самого начала лечения следует информировать о том, что при приеме данного препарата у большинства людей наблюдается обратимое изменение цвета кожи. Окрашивание кожи в оранжевые и коричневые тона пропадает через несколько месяцев после прекращения приема клофазимина (иногда больше) и не считается опасным. Пациенты могут испытывать сильное беспокойство в связи с вышеуказанными изменениями кожного покрова и нуждаются в подтверждении того, что такие явления не представляют угрозы. Не следует принимать клофазимин во время беременности или лактации по причине недостаточного объема данных и из-за возникновения пигментации у детей в результате приема препарата в период грудного вскармливания. Клофазимин частично метаболизируется в печени, в связи с чем рекомендуется с осторожностью назначать его пациентам с тяжелой печеночной недостаточностью или корректировать дозировку соответственно.
Циклосерин
Циклосерин – это препарат, обладающий бактериостатическим действием и ингибирующий синтез клеточной оболочки; информация о наличии у циклосерина перекрестной устойчивости с другими противотуберкулезными препаратами отсутствует. Вместо циклосерина может также использоваться препарат под названием теризидон (состоит из двух молекул циклосерина). Циклосерин и теризидон считаются взаимозаменяемыми. Ввиду трудностей, связанных с интерпретацией ТЛЧ (надежного генотипического или фенотипического ТЛЧ для циклосерина и теризидона в настоящее время не существует), циклосерин и теризидон должны рассматриваться в качестве возможных компонентов лечения только в случае выполнения прочих критериев вероятности эффективности; так, например, должны иметься любые достоверные данные о лекарственной устойчивости на популяционном уровне и прошлый опыт использования циклосерина и теризидона, подкрепленный достоверным анамнезом лечения (см. раздел 3.1). Пациенты должны быть должным образом проинформированы о возможных нежелательных реакциях на циклосерин. К серьезным нежелательным реакциям на препарат относится его токсическое воздействие на ЦНС, включая неспособность к концентрации, депрессию, изменения в поведении (например, грубость, агрессивность, суицидальные настроения), манифестный психоз, судороги и сильную вялость.
Циклосерин может усугублять ранее имевшиеся у пациента неврологические или психиатрические патологии. Пациенты с МЛУ/РУ-ТБ достаточно часто подвергаются стигматизации, живут в условиях крайней нищеты и социальной уязвимости, что также негативно влияет на их психическое здоровье. Кроме того, у них очень часто присутствуют депрессии и тревожность, которые могут ухудшить прогноз заболевания и привести к потере для последующего наблюдения, особенно если в программах не применяются подходы, ориентированные на нужды и интересы пациента. В подобных ситуациях чрезвычайно важно бороться с токсическим воздействием циклосерина, что позволит добиться хороших клинических результатов и избежать серьезных нежелательных реакций.
Группа C
Группа C включает в себя как противотуберкулезные, так и перепрофилированные препараты, которые являются менее предпочтительными, чем препараты из групп A и B, ввиду их более низкой эффективности (этамбутол, деламанид, пиразинамид, этионамид/протионамид и парааминосалициловая кислота) или более высокой токсичности и неудобной формы парентерального применения (имипенем-циластатин, меропенем, амикацин и стрептомицин). Эти препараты обычно включают в длительный режим лечения в тех случаях, когда он не может состоять исключительно из препаратов, входящих в группы A и B.
Этамбутол
Этамбутол является противотуберкулезным препаратом, который используется при лечении ЛЧ-ТБ и может быть включен в длительные режимы лечения МЛУ-ТБ. Этамбутол отличается высоким уровнем безопасности при условии соблюдения рекомендуемых дозировок. Ввиду трудностей, связанных с интерпретацией ТЛЧ, этамбутол должен рассматриваться в качестве возможного компонента лечения только в случае выполнения прочих критериев вероятности эффективности (например, должны иметься данные о низкой распространенности лекарственной устойчивости циркулирующих штаммов МЛУ/РУ-ТБ на популяционном уровне, а также должен отсутствовать прошлый опыт использования этамбутола, что должно подтверждаться достоверной историей лечения).
Деламанид
С учетом современных данных об эффективности и безопасности деламанида этот препарат рекомендуется использовать в качестве одного из представителей группы С (1). Деламанид обладает мощным бактерицидным эффектом in vitro и потенциальным стерилизующим эффектом; предполагается, что производные нитроимидазооксазола генерируют активные формы азота, включая оксид азота, которые ответственны за отравление клеток в состоянии низкого метаболизма. Возрастные ограничения для деламанида отсутствуют; в настоящее время он выпускается в растворимых формах, которые желательно применять вместо раздробленных и растворенных таблеток во взрослой дозировке (47, 92). Деламанид прочно связывается с белками плазмы, что влечет за собой его плохое проникновение в ЦНС; однако исследования на людях и животных с ТБ ЦНС показали, что деламанид может принести пользу при отсутствии других вариантов лечения (93).
Анализ последних данных, проводившийся при подготовке руководства ВОЗ (1), не предполагает дополнительных опасений относительно безопасности при одновременном приеме деламанида и бедаквилина. Их совокупное влияние на интервал QT по сравнению с воздействием приема только бедаквилина или только деламанида оценивалось в ходе РКИ с участием 75 пациентов (> 3000 ЭКГ) (78). Исследования, проводившиеся в период с 2020 по 2022 г., не показали повышения токсичности при применении деламанида на протяжении более 6 месяцев; они продемонстрировали, что деламанид безопасен при одновременном применении с бедаквилином и улучшает показатели выживаемости у пациентов с ограниченными возможностями для терапии (67, 81).
Исследования на животных не показали признаков тератогенности деламанида. Число беременных женщин, принимавших деламанид, было небольшим, однако все роды у них прошли полностью благополучно, из чего следует, что беременным женщинам не следует отказывать в лечении деламанидом, если оно необходимо. Этот препарат может рассматриваться для лечения ЛУ-ТБ у беременных женщин с ограниченными возможностями для терапии (50).
Пиразинамид
Пиразинамид в стандартном порядке включался в режимы лечения МЛУ-ТБ в качестве одного из компонентов, за исключением случаев, когда имелись разумные клинические противопоказания для его применения (например, гепатотоксичность), а также если наблюдались другие серьезные нежелательные реакции или лекарственная устойчивость. В то же время далеко не везде имеются возможности для проведения достоверного ТЛЧ к пиразинамиду, и в результате данный препарат нередко применяется без ТЛЧ или невзирая на документально подтвержденную устойчивость. Пиразинамид рекомендуется включать в длительные режимы лечения только в тех случаях, когда результаты ТЛЧ подтверждают чувствительность к этому препарату (и тогда он учитывается в качестве одного из эффективных лекарственных средств); во всех прочих случаях пиразинамид в составе режима лечения не учитывается как один из четырех эффективных препаратов (94, 95). Благодаря сложным механизмам действия, направленным на неактивные бактерии, между пиразинамидом и другими препаратами, например бедаквилином, возникает синергия.
Имипенем-циластатин и меропенем
Имипенем-циластатин (не используется у пациентов младше 15 лет) и меропенем – это единственные карбапенемы, которые были утверждены в качестве компонентов режимов лечения МЛУ-ТБ. Существенным недостатком обоих препаратов является необходимость их внутривенного введения, что ограничивает возможности их более широкого применения вне учреждений здравоохранения, и особенно в условиях нехватки ресурсов (96–100). Для выполнения ежедневных в/в инъекций обычно требуется порт-система, которая устанавливается хирургическим путем, или периферический катетер, соединенный с крупной веной. Было доказано, что применение меропенема в сочетании с клавуланатом в режимах лечения МЛУ-ТБ и ШЛУ-ТБ (обычно также включающих линезолид) способствует улучшению конверсии культуры и показателей выживаемости (101–103). Клавулановая кислота (в виде коамоксиклава) является не противотуберкулезным средством, а дополнительным препаратом, который принимается перорально при каждом введении очередной дозы карбапенема, за 30 минут до в/в инфузии. Клавулановая кислота как один из компонентов режима лечения не считается противотуберкулезным препаратом и принимается только в сочетании с карбапенемом.
Амикацин и стрептомицин
Амикацин и стрептомицин – это единственные аминогликозидные антибиотики, которые могут использоваться в ситуациях ограниченного выбора допустимых компонентов. Согласно данным, проанализированным в 2018 г., применение амикацина и стрептомицина было связано с более низкими показателями неэффективности лечения или рецидива и летального исхода у пациентов со штаммами M. tuberculosis, чувствительными к амикацину или стрептомицину. Тем не менее эти препараты обладают теми же недостатками и серьезными токсическими эффектами (в том числе ототоксичностью и нефротоксичностью), что и другие инъекционные препараты, которые более не рекомендуются к применению (например, канамицин и капреомицин). Учитывая, что у многих пациентов с МЛУ/РУ-ТБ в разных условиях часто наблюдается устойчивость к стрептомицину и что в прошлом он активно использовался во многих странах в качестве одного из компонентов режима лечения ТБ препаратами первого ряда, маловероятно, что стрептомицин будет широко применяться в составе режимов лечения МЛУ-ТБ.
Этионамид и протионамид
В руководстве ВОЗ этионамид и протионамид фигурируют как взаимозаменяемые препараты. Согласно условной рекомендации, которая содержится в сводном руководстве ВОЗ, их применение в рамках длительных режимов лечения не рекомендуется и допускается только в ситуациях, когда нет возможности использовать многие другие более эффективные препараты (например, бедаквилин, линезолид и клофазимин). Помимо низкой бактерицидной активности, применение этионамида и протионамида ограничивается плохой переносимостью со стороны желудочно-кишечного тракта, которая может потенциально приводить к несоблюдению режима лечения. Применение этих препаратов у беременных женщин обычно не рекомендуется по причине плохой переносимости, снижения уровня тиреотропного гормона (ТТГ), который имеет основополагающее значение для развития плода, а также опасений, вызванных воздействием препаратов в исследованиях репродуктивной функции животных.
Парааминосалициловая кислота
Парааминосалициловая кислота (ПАСК) может рассматриваться в качестве компонента лечения МЛУ/РУ-ТБ лишь в самых крайних случаях. Она зачастую плохо переносится и обладает умеренным бактериостатическим действием. Согласно сводному руководству ВОЗ, данный препарат рекомендуется назначать пациентам, находящимся на длительных режимах лечения МЛУ/РУ-ТБ, лишь в ситуациях, когда бедаквилин, линезолид, клофазимин или деламанид не применяются или нет возможности включить в режим лечения более эффективные компоненты. Никаких данных, указывающих на наличие перекрестной устойчивости между ПАСК и другими противотуберкулезными препаратами, на сегодняшний день не имеется (1). Использование ПАСК ограничено по причине плохой переносимости препарата со стороны желудочно-кишечного тракта.
Прочие препараты
Некоторые препараты, которые ранее были рекомендованы в качестве возможных компонентов длительных режимов лечения МЛУ-ТБ, не вошли в группы А–С.
Высокодозный изониазид
Высокодозный изониазид не был включен в группы A–C по причине его редкого использования в режимах лечения взрослых пациентов. Этот препарат считается относительно безопасным: в ходе недавнего многоцентрового обсервационного исследования было установлено, что при дозе изониазида, составляющей 10 мг/кг, лишь у 0,5% из 1006 пациентов, находившихся на коротком режиме лечения МЛУ-ТБ, была выявлена нейротоксичность уровня 3 или 4 (104). Имеются также фактические данные, свидетельствующие о том, что высокодозный изониазид может быть использован в длительных режимах лечения МЛУ-ТБ. Во-первых, в ходе систематического обзора и метаанализа ИДП, которые проводились по поручению ВОЗ в 2015 г. в целях описания результатов лечения детей с МЛУ-ТБ (участвовали 975 детей из 18 стран), было установлено, что применение высокодозного изониазида способствовало успешному лечению детей с подтвержденным МЛУ-ТБ (скорректированное отношение шансов (СОШ) = 5,9, 95%-ный доверительный интервал (ДИ) = 1,7–20,5, P = 0,007) (105, 106). Во-вторых, в двойном слепом рандомизированном плацебо-контролируемом клиническом испытании, которое проводилось среди взрослых пациентов с МЛУ-ТБ, у участников, получавших высокодозный изониазид (16–18 мг/кг) (в качестве дополнения к канамицину, левофлоксацину, протионамиду, циклосерину и ПАСК), значительно чаще наблюдалась конверсия культуры по итогу 6 месяцев лечения, чем у тех, кто получал плацебо или изониазид в стандартной дозе (5 мг/кг) (73,8% по сравнению с 48,8% или 45,0% соответственно), и в группе, получавшей высокодозный изониазид, медиана времени до конверсии культуры значительно сократилась (3,4 по сравнению с 6,6 или 6,4 месяца соответственно) (107). В-третьих, в недавнем исследовании ранней бактерицидной активности, проводившемся среди пациентов с МЛУ-ТБ (в тех случаях, когда устойчивость к изониазиду была обусловлена изолированными мутациями в гене inhA), было установлено, что у пациентов с ЛЧ-ТБ изониазид в дозировке 10–15 мг/кг/сут демонстрирует ту же бактерицидную активность, что и изониазид в стандартной дозировке (5 мг/кг) (108). Штаммы с изолированной мутацией в гене katG или с мутациями в обоих генах katG и inhA, скорее всего, не будут реагировать даже на высокодозный изониазид, поскольку для таких штаммов, как правило, необходим высокий уровень МИК изониазида. В отсутствие информации о сочетаниях относящихся к изониазиду мутаций у отдельного пациента для принятия решения об оптимальных режимах лечения может также оказаться полезной информация о распространенности одновременного возникновения обеих мутаций в циркулирующих в данной местности штаммах РУ-ТБ (например, полученная в результате DRS в конкретной эпидемиологической ситуации).
 Обратная связь
Обратная связь