Liens transversaux de livre pour 5.1 Recommended TPT regimens
Dosages recommandés des constituants du TPT
L’équipe de l’OMS chargée de la pharmacocinétique et la pharmacodynamique a analysé les données factuelles disponibles issues d’essais cliniques sur la rifapentine et a suggéré une dose simplifiée pour différentes tranches de poids pour les protocoles 3HP et 1HP comme résumé dans le Tableau 5.2 (mise à jour 2020 des lignes directrices). Le Tableau 5.2 présente les dosages types pour les protocoles de TPT recommandés par âge et par poids corporel.
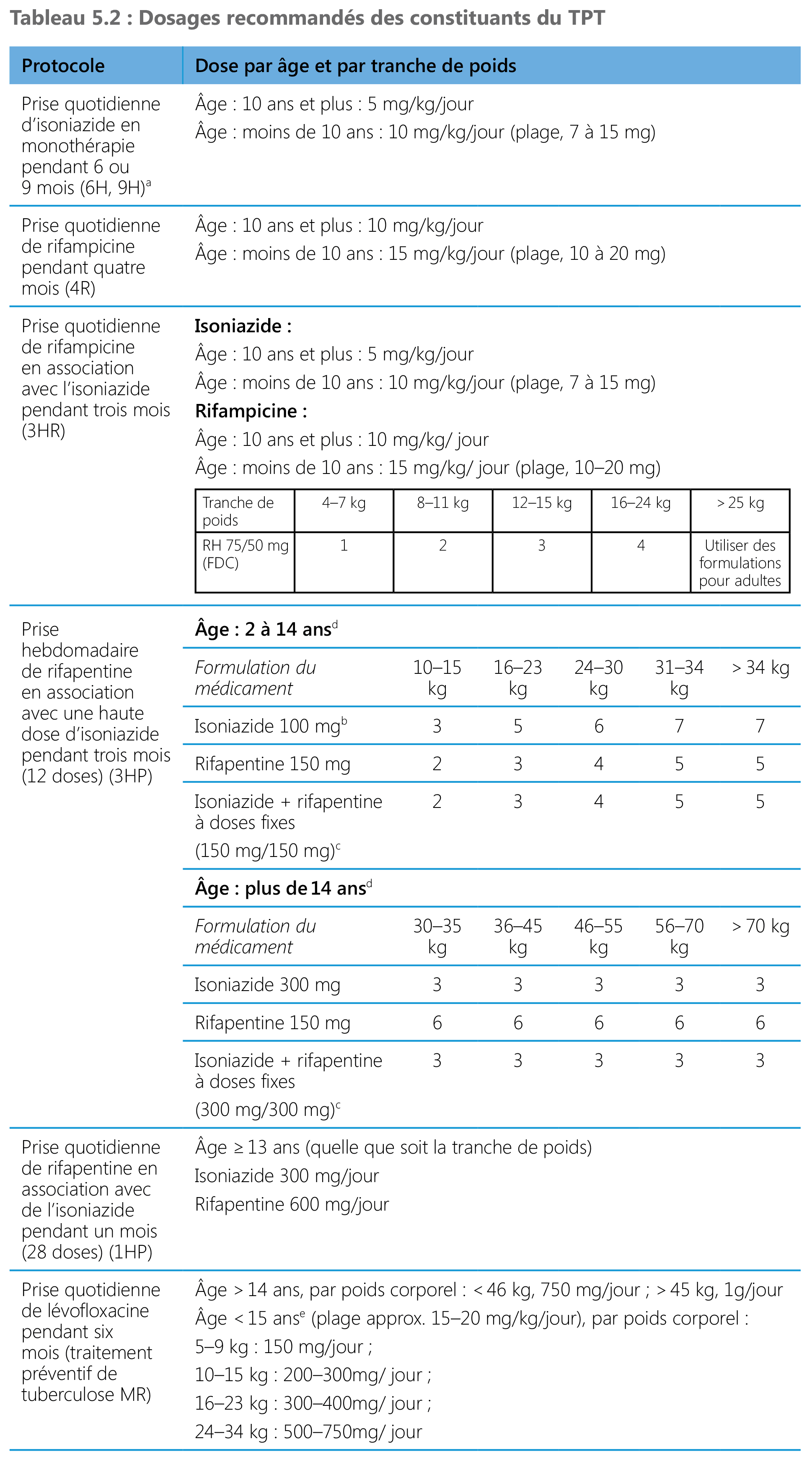
ᵃ Les comprimés contenant une triple association d’isoniazide 300 mg + pyridoxine 25 mg + sulfaméthoxazole 800 mg + triméthoprime 160 mg (sécable) est le protocole optionnel préféré pour les personnes vivant avec le VIH pour lesquelles on envisage une monothérapie à l’isoniazide (1 comprimé chaque jour pour adultes, un demi comprimé pour enfants de cinq ans et plus et un quart de comprimé pour enfants de moins de cinq ans).
b Une formulation de 300 mg peut être utilisée pour réduire le grand nombre de comprimés absorbés.
c Devraient être disponibles dans un futur proche.
d Le dosage peut différer selon les adultes et les enfants par le chevauchement de tranches de poids.
e La lévofloxacine de 100 mg en comprimés dispersibles est disponible pour les enfants.
Les protocoles contenant de l’isoniazide et de la rifampicine peuvent être utilisés à tout âge mais on dispose de peu de données de pharmacocinétique pour appuyer le bon dosage et l’innocuité de la rifapentine chez les enfants de moins de deux ans ; c’est pourquoi le protocole 3HP est recommandé uniquement pour les enfants de deux ans et plus. Par ailleurs, les données issues de l’essai sur le protocole 1HP ne concernent que les sujets de 13 ans et plus. La bonne dose quotidienne de rifapentine chez les enfants de moins de 13 ans n’est donc pas encore déterminée et en conséquence, la pertinence du protocole 1HP pour les moins de 13 ans doit être réévaluée lorsque les données de pharmacocinétique et les études sur l’innocuité chez l’enfant seront disponibles.
Disponibilité des formulations appropriées
Rifampicine: compte tenu de l’utilisation largement répandue des associations à doses fixes contenant de la rifampicine pour traiter les cas de tuberculose pharmacosensible, la rifampicine en dose unique est moins couramment utilisée et donc, moins achetée ; c’est pourquoi il est probable qu’elle ne soit disponible qu’en faibles quantités pour les programmes nationaux. De plus, les formulations pédiatriques en comprimés monodose dispersibles de rifampicine ne sont pas disponibles actuellement. Si le protocole 4R est préconisé, la demande de comprimés de rifampicine au détail augmentera et les programmes devront identifier les fournisseurs de rifampicine à doses uniques, fournisseurs dont la qualité doit être assurée. L’utilisation de rifampicine doit aussi être réglementée et limitée au cadre des protocoles de TPT. La rifampicine ne doit pas être détournée pour être utilisée comme antibiotique à large spectre. La fourniture de traitements 4R aux centres périphériques (établissements de soins primaires, programmes de lutte contre le VIH) doit s’accompagner de recommandations transmises point par point sur l’utilisation spécifique de la rifampicine.
Isoniazide + rifampicine à doses fixes: les comprimés dispersibles du protocole 3HR à doses fixes adapté aux enfants sont disponibles et déjà utilisés dans de nombreux pays pour le traitement de la tuberculose-maladie chez l’enfant. Les mêmes formulations peuvent être utilisées pour le TPT. Les associations à doses fixes adaptées aux enfants doivent être préférées aux comprimés monodose pour réduire la lourdeur de la prise de nombreux comprimés. De même, les associations à doses fixes destinées au traitement de la tuberculose-maladie chez l’adulte peuvent être utilisées dans les TPT pour adultes.
Isoniazide + rifapentine (hebdomadaire/quotidien): La seule formulation contenant la rifapentine actuellement disponible est le comprimé monodose de 150 mg. La prise de plusieurs comprimés monodose dans les protocoles 3HP et 1HP pour adultes est très fastidieuse. La mise au point d’une association à doses fixes du protocole 3HP (avec un rapport de un à un de rifapentine et d’isoniazide) a commencé et le protocole 3HP à doses fixes pour adultes sera probablement disponible en 2020. Cela réduira la lourdeur de ce protocole 3HP pour adultes puisque le nombre de comprimés absorbés passera ainsi de neuf à trois. Un comprimé monodose de 300 mg de rifapentine est aussi en cours de mise au point et sera peut-être disponible en 2020, ce qui réduira aussi à trois le nombre de comprimés absorbés dans le protocole 1HP. De même, des formulations à doses fixes adaptées aux enfants pour le protocole 3HP (150 mg/150 mg) rendront la prise de comprimés pour enfants moins pénible lorsqu’ils seront disponibles. Des recherches complémentaires visant à déterminer la bonne dose de rifapentine et à identifier les interactions médicamenteuses (comme le dolutégravir) chez les enfants de moins de deux ans pour les deux protocoles thérapeutiques 3HP et 1HP faciliteront l’application de ces deux protocoles dans cette tranche d’âge.
Isoniazide + cotrimoxazole + pyridoxine: cette association est disponible à bas prix grâce au Service pharmaceutique mondial du Partenariat Halte à la tuberculose et au dispositif d’achats groupés du Fonds mondial. Les comprimés de cette association peuvent être considérés comme une variante pour les personnes vivant avec le VIH lorsque : des protocoles thérapeutiques plus courts contenant de la rifamycine ne sont pas disponibles, des interactions médicamenteuses surviennent ou lors d’un plus large déploiement progressif. Il existe des comprimés monodose sécables. Par conséquent, si la dose requise correspond à un tiers de la formulation pour adultes, cette association à doses fixes ne pourra pas être utilisée pour les enfants de moins de cinq ans infectés par le VIH.
Rôle et disponibilité de la pyridoxine
Pyridoxine (vitamine B6): l’un des effets indésirables d’un traitement de longue durée contenant une forte dose d’isoniazide est une neuropathie périphérique qui résulte d’une carence en vitamine B6 (pyridoxine) et se développe pendant une thérapie. Les personnes exposées au risque de neuropathie périphérique, comme celles souffrant de malnutrition ou qui présentent une dépendance chronique à l’alcool ou une insuffisance rénale ou un diabète ou sont infectées par le VIH ou encore les femmes enceintes ou allaitantes, doivent recevoir une supplémentation de vitamine B6 lorsqu’elles prennent un traitement contenant de l’isoniazide. De plus, les femmes enceintes ou en postpartum et les nourrissons nourris exclusivement au sein maternel doivent recevoir de la vitamine B6 en cas de prise d’isoniazide. La dose standard de pyridoxine est de 10 à 25 mg par jour lorsqu’elle est administrée à des fins de prophylaxie pour prévenir une neuropathie chez les patients prenant de l’isoniazide. La neuropathie périphérique se manifeste parfois chez d’autres patients recevant des doses standards d’isoniazide et elle est facilement reconnaissable (engourdissement symétrique et fourmillement dans les extrémités) mais elle est généralement facilement réversible dès l’arrêt de l’isoniazide et l’administration d’une thérapie à haute dose de pyridoxine (100 à 200 mg par jour). Ainsi, une supplémentation systématique de pyridoxine pendant un traitement à l’isoniazide n’est probablement pas nécessaire et son absence ne doit pas faire obstacle au lancement d’un TPT.
In vivo, la pyridoxine se transforme en coenzymes qui jouent un rôle essentiel dans le métabolisme de protéines, de carbohydrates, d’acides gras et de plusieurs autres substances, notamment des amines cérébrales. Apparemment, l’isoniazide inhibe de façon compétitive l’action de la pyridoxine dans ces fonctions métaboliques (59). La survenue d’une neuropathie périphérique est en corrélation étroite avec la dose d’isoniazide administrée. Des études réalisées dans les années 50 (60–62) ont permis de constater que même si un fort pourcentage (plus de 40 %) des personnes recevant une haute dose d’isoniazide (16 à 24 mg/kg/jour) présentent des signes et des symptômes de neuropathie périphérique, seulement 2 % de celles recevant 4 à 6 mg/kg/jour ont développé une neuropathie. Si l’administration d’isoniazide à haute dose peut être pertinente dans le traitement de certaines formes de tuberculose-maladie, dans le TPT, c’est la dose standard d’isoniazide qui est utilisée. Des signes de toxicité apparaissent bien plus tard chez les personnes prenant de plus faibles doses d’isoniazide. Le tout premier symptôme est généralement une paresthésie, suivie de sensations de piqûres et de brûlure dans les pieds et plus tard, dans les mains (engourdissement et fourmillements symétriques). Sans traitement, ces symptômes empirent et provoque de l’angoisse. Ils sont facilement reconnaissables et régressent généralement dès l’arrêt de l’isoniazide et la mise en place d’une thérapie à la pyridoxine.
La supplémentation systématique de pyridoxine chez des personnes autrement en bonne santé qui reçoivent une dose standard d’isoniazide n’est sans doute pas justifiée ni indispensable (62). Cependant, même de faibles doses d’isoniazide peuvent provoquer une neuropathie chez les patients malnutris (jusqu’à 20 %) (63), et parmi les acétyleurs lents de l’isoniazide7 (jusqu’à 20 % avec 4 à 6 mg/kg d’isoniazide). D’autres sujets connus pour être exposés à un risque plus élevé de neuropathie périphérique sont les personnes qui présentent une dépendance chronique à l’alcool, une insuffisance rénale ou un diabète ou sont infectées par le VIH, ou encore les femmes enceintes ou allaitantes. L’administration simultanée de pyridoxine et d’isoniazide assure une protection contre le développement d’une neuropathie périphérique chez ces personnes.
Un régime alimentaire humain satisfaisant contenant chaque jour 1 à 2 mg d’un composé de vitamine B6 peut protéger contre l’hépatotoxicité de l’isoniazide. Les aliments sources de vitamine B6 sont notamment les carottes, les épinards, les pois, les pommes de terre, le lait, le fromage, les oeufs, le poisson, la viande et la farine enrichie. Autrement, une petite dose quotidienne de 10 à 25 mg de pyridoxine peut être administrée en même temps que le TPT aux personnes à haut risque.La pyridoxine peut être donnée dans le cadre des suppléments du complexe vitaminique B, en particulier chez les sujets pouvant présenter aussi une carence en d’autres vitamines. Dans le cas d’une neuropathie périphérique avérée due à l’isoniazide, la pyridoxine doit être donnée à une dose thérapeutique plus forte de 50 à 75 mg par jour, voire jusqu’à 100 à 200 mg par jour (64). Il est important de maintenir la supplémentation en pyridoxine à la bonne dose car des niveaux plus élevés pourraient interférer avec l’activité antibactérienne de l’isoniazide. De plus, selon certaines déclarations, des doses extrêmement élevées de pyridoxine (2000 mg par jour ou plus) ont été à l’origine de toxicité, notamment de neuropathie périphérique (65–67).
Actuellement, la formulation de pyridoxine disponible selon le dispositif d’achats groupés du Fond mondial et figurant dans la liste de produits du Service pharmaceutique mondial consiste en comprimés non enrobés de 50 mg et en comprimés pelliculés de 100 mg (51). Ces deux formulations sont essentiellement destinées à un usage thérapeutique et sont difficiles à casser pour obtenir le dosage recommandé en supplémentation prophylactique. Les programmes nationaux peuvent envisager d’acheter localement de la pyridoxine à dose plus faible (10 à 25 mg) dont la qualité est assurée pour l’administrer à des sujets à haut risque ou, en variante, acheter un complexe vitaminique B. Pour les personnes vivant avec le VIH, l’utilisation d’une association isoniazide-B6-cotrimoxazole en comprimés peut être envisagée. Néanmoins, il est conseillé aussi aux programmes de stocker des doses plus fortes de pyridoxine (disponible selon la liste de produits du Service pharmaceutique mondial) pour le traitement de la neuropathie périphérique.
Message important: Lors du déploiement des services de TPT, le manque de pyridoxine ne doit pas faire obstacle au lancement d’un TPT. Une évaluation clinique du risque de neuropathie doit être entreprise avant de prescrire une supplémentation en pyridoxine.
Introduction et déploiement d’un TPT
Réflexions sur la mise en oeuvre d’un TPT par les programmes
• Définir les rôles et responsabilités des cadres d’agents de santé pour la prescription d’un TPT. Médecins, personnel infirmier et agents de santé périphériques dûment formés peuvent évaluer et commencer un TPT une fois écartée avec certitude l’éventualité d’une tuberculose-maladie, suivant un protocole national. Le personnel infirmier et les agents de santé intervenant en première ligne dans des centres périphériques peuvent aussi être formés à la surveillance d’un TPT et décider de le suspendre ou de le modifier (par exemple dans le cas de manifestations indésirables) ou de le relancer (par exemple après une interruption par la personne sous traitement). Dans la plupart des cas, il n’est pas nécessaire de demander l’avis d’un médecin ou d’un spécialiste pour ce type de décisions mais il devrait exister une règle permettant de solliciter une aide si le besoin s’en fait sentir.
• Déterminer à quels niveaux du système de santé un TPT peut être lancé et les médicaments, renouvelés, pour la poursuite du traitement.
• Élaborer des modes opératoires normalisés pour lancer un TPT et en assurer le suivi afin de :
– maintenir le flux de personnes envisagées pour bénéficier d’un TPT dans différents établissements de santé et au travers de différents services dans ces établissements ;
– vérifier le rôle et les responsabilités des prestataires de santé, des agents de santé communautaires et des principales parties prenantes (comme les services de soins aux malnutris, les prisons, les maisons de correction, les camps de réfugiés, les communautés de mineurs) pour évaluer l’admissibilité des personnes et commencer un TPT ;
– apporter une aide à l’observance du TPT ;
– gérer les interruptions de TPT ; et enfin
– identifier, justifier et prendre en charge les manifestations indésirables faisant suite à la prise de médicaments.
• Mettre en place des services de TPT dans tous les sites de prestation de services concernés (comme un site de traitement de la tuberculose, des centres de traitement par antirétroviraux, des centres de santé de la mère et de l’enfant, des centres de santé communautaires).
• Décentraliser au profit des centres de la tuberculose assurant des traitements par ARV ou des traitements antituberculeux (lancement et continuation) les plus proches possibles du domicile de la personne afin de réduire au minimum le temps de trajet pour recevoir un TPT.
• Tirer parti des services existants de traitement de la tuberculose, du VIH et des services de santé en général pour assurer les soins spécialisés éventuellement nécessaires aux personnes sous TPT (comme la prise en charge des manifestations indésirables, des interactions médicamenteuses ou des situations particulières (grossesse)).
• Évaluer la capacité et la disponibilité des agents de soins de santé et évaluer d’autres besoins pour étendre les services de TPT à l’ensemble du pays.
• Évaluer la disponibilité et la capacité des agents de santé communautaires et d’autres réseaux (comme les associations d’anciens malades de la tuberculose) susceptibles de contribuer à la prestation des services de TPT et d’apporter un soutien aux malades.
• Renforcer :
– les capacités par une formation initiale et une sensibilisation et renforcer les moyens d’action du personnel ;
– la capacité des médecins, du personnel infirmier et d’autres agents de santé assurant les soins de santé primaires à enregistrer les antécédents, à identifier les symptômes et à orienter les patients vers des services d’investigation, à évaluer l’admissibilité à un TPT et à démarrer un TPT ; et enfin
– la capacité des agents de santé communautaires à administrer le TPT et en assurer le suivi.
• Entreprendre la planification de l’introduction et de l’arrêt graduel des médicaments constituant les TPT (dans une perspective d’achats) au fur et à mesure que le programme national passe progressivement à des protocoles de TPT plus courts. Ce point est important lors de la mise en place d’un nouveau protocole thérapeutique.
• Revoir et renforcer le dispositif de quantification, de commande et d’approvisionnement ininterrompu en produits de base (tels les médicaments constituant le TPT, la pyridoxine).
• Se pencher sur des problèmes particuliers concernant les TPT pour enfants afin de :
– coordonner le TPT avec des ménages regroupant de nombreux membres de la famille (parents/grands-parents) car des enfants peuvent recevoir des soins dans de nombreux sites de prestation des services (comme les services de santé de la mère et de l’enfant, les centres de traitement de la tuberculose ou du VIH) ;
– renforcer les capacités de conseils et d’action en cas de vomissements après prise des doses et indications pour modifier le dosage ; et
– fournir des informations sur les aliments pouvant masquer le goût des médicaments.
• Renforcer l’enregistrement et la notification systématiques, notamment les informations tirées de formulaires ou, en variante, saisir les informations sur des bases de données électroniques. Les principales variables doivent être intégrées au système d’information pour la gestion sanitaire en vue de suivre et d’évaluer les résultats.
Lancement d’un TPT et évaluation préalable de référence
Après avoir écarté l’éventualité d’une tuberculose-maladie et avoir pris la décision d’envisager un TPT, il faut entreprendre une évaluation de référence pour déterminer si la personne est admissible à un TPT. Cette évaluation porte sur les antécédents personnels et médicaux et sur des enquêtes, conformément aux directives nationales.
• Antécédents personnels : obtenir des informations sur le lancement et la poursuite d’un TPT, comme
– une allergie ou une hypersensibilité connue aux antituberculeux (isoniazide, rifampicine, rifabutine ou rifapentine)
– statut sérologique pour le VIH et protocole thérapeutique par ARV
– grossesse ou méthode de contrôle des naissances appliquée
– comorbidité : évaluer la présence de comorbidités (comme une malnutrition, un diabète, une hépatite virale) et enregistrer les médicaments prescrits
– sujets contacts de patients atteints de tuberculose à bacilles résistants (isoniazide, rifampicine en monothérapie ou tuberculose MR)
– contre-indications possibles à un TPT : par exemple hépatite évolutive (aiguë ou chronique) ou hausse connue des transaminases (plus de 3 fois la limite supérieure de la normale), consommation régulière ou excessive d’alcool et symptômes de neuropathie périphérique. Ces pathologies devraient inciter à procéder à des enquêtes approfondies et à appliquer des critères cliniques pour mettre en balance les méfaits et les bienfaits du TPT et déterminer le moment opportun pour commencer un TPT si les bienfaits compensent les méfaits. Un traitement antituberculeux antérieur ou une grossesse en cours ne doivent pas être considérés comme des contre-indications au lancement d’un TPT.
• Antécédents de traitements : obtenir les antécédents de traitements pour orienter le choix du protocole pour le TPT ou pour déterminer s’il faut modifier le traitement de comorbidités. Certaines classes de médicaments – ARV, opioïdes, antipaludéens – ont souvent une incidence préjudiciable sur le TPT.
• Test de la fonction hépatique (TFH) : Les données probantes sont insuffisantes pour justifier que l’on rende obligatoire ou systématique un test de la fonction hépatique (68) et peut-être que les bienfaits du TPT sans TFH pourraient compenser les méfaits, surtout si l’on réduit les médicaments hépatotoxiques. Cependant, et dans la mesure du possible, un test de référence est fortement recommandé pour les personnes exposées à des facteurs de risque – comme des antécédents d’atteinte hépatique, une consommation régulière d’alcool, une maladie du foie chronique, une infection par le VIH, être âgé de plus de 35 ans et enfin une grossesse ou la période du postpartum (dans les 3 mois qui suivent la délivrance). Lorsque les résultats de TFH de référence indiquent une anomalie, il est impératif de procéder à un examen clinique rigoureux pour déterminer si les bienfaits du TPT compensent le risque de manifestations indésirables. Les personnes dans ce cas doivent être soumises régulièrement à des tests lors de fréquentes visites.
Point important : Il n’est pas nécessaire de procéder systématiquement à un test de la fonction hépatique (TFH) avant de commencer un TPT. Selon les données probantes disponibles, une surveillance clinique étroite des signes et des symptômes d’une atteinte hépatique est suffisante pour la détection précoce et la prise en charge des manifestations indésirables, d’autant plus s’il s’agit de protocoles plus courts de TPT contenant de la rifamycine. Par contre, un TFH est préconisé pour les personnes exposées à d’autres facteurs de risque.
• Situation sociale et financière de la personne et de la famille : elle doit être évaluée : et un soutien est indispensable pour leur permettre de surmonter les obstacles identifiés à l’achèvement satisfaisant d’un TPT.
• Conseils :
– Expliquer à la personne qu’elle est admissible à un TPT et lui communiquer les principaux messages ainsi qu’à sa famille et/ou à ceux qui la soutiennent dans son traitement, à savoir :
▪ la raison d’être du TPT et ses bienfaits pour le patient, le ménage et, plus largement, la communauté ;
▪ le TPT est gratuit par l’intermédiaire des programmes nationaux ;
▪ le protocole prescrit pour le TPT, notamment sa durée, les indications pour la prise des médicaments et le calendrier de suivi ;
▪ les effets secondaires et les manifestations indésirables possibles et ce qu’il faut faire en cas d’effets secondaires ;
▪ l’importance de l’achèvement le TPT dans son intégralité ;
▪ les raisons et le calendrier du suivi régulier clinique et en laboratoire pour la surveillance du traitement ; et enfin
▪ les signes et symptômes de la tuberculose et les conseils sur les étapes à suivre s’ils sont constatés.
– Donner son accord sur la meilleure méthode de soutien de l’observance du traitement, notamment le lieu le plus commode pour prendre les médicaments et recevoir une aide au traitement, selon la préférence de chaque patient. Plusieurs options sont possibles :
▪ Le lieu : au domicile du patient, dans la communauté ou dans l’établissement de santé (où l’on reçoit des conseils).
▪ L’aide au patient dans son traitement : déterminer si le patient a besoin d’une aide pour prendre son traitement ou s’il peut se l’administrer lui-même. Si une aide est nécessaire, plusieurs options sont possibles : un membre de la famille soucieux d’aider ou un volontaire de la communauté ou un partenaire sur le lieu de travail ou un agent de soins de santé surveillent le traitement. Pour un protocole hebdomadaire, il est préférable que chaque dose soit prise sous la surveillance directe du membre de la famille soucieux d’aider ou du volontaire de la communauté ou du partenaire sur le lieu de travail ou d’un agent de soins de santé (en personne ou au moyen d’un outil numérique).
▪ Les outils numériques : concernent les traitements pris sous observation par vidéo, les rappels par SMS ou appels téléphoniques manqués.
Observance
L’observance et l’achèvement d’un TPT sont d’importants déterminants des bienfaits cliniques, tant au niveau individuel qu’au niveau de la population (chapitre 7). Dans le cas d’un traitement irrégulier ou inapproprié, l’efficacité protectrice du TPT s’en trouve réduite. Par ailleurs, une mauvaise observance du TPT ou son interruption précoce peut accroître le risque pour la personne de développer une tuberculose voire une tuberculose à bacilles résistants (bien qu’aucun résultat d’études de recherche ne puisse étayer ce point). On sait qu’un TPT est beaucoup plus efficace si au moins 80 % des doses sont prises pendant la durée du protocole. Le nombre total de doses prises est aussi un déterminant important du degré de la prévention antituberculeuse (69,70).
Des essais ont utilisé différentes définitions de l’achèvement d’un traitement préventif dans son intégralité – 80 % des doses recommandées sont consommées sur 120 % de la durée prévue du TPT (71), ou 90 % des doses recommandées sont consommées sur 133 % de la durée prévue du TPT (72). Le Tableau 5.3 ci-dessous présente une synthèse de tous les protocoles thérapeutiques recommandés et des critères suggérés pour évaluer le degré d’achèvement de ces différents protocoles. On peut supposer que des protocoles plus courts sont mieux observés et aboutissent à un meilleur taux d’achèvement.
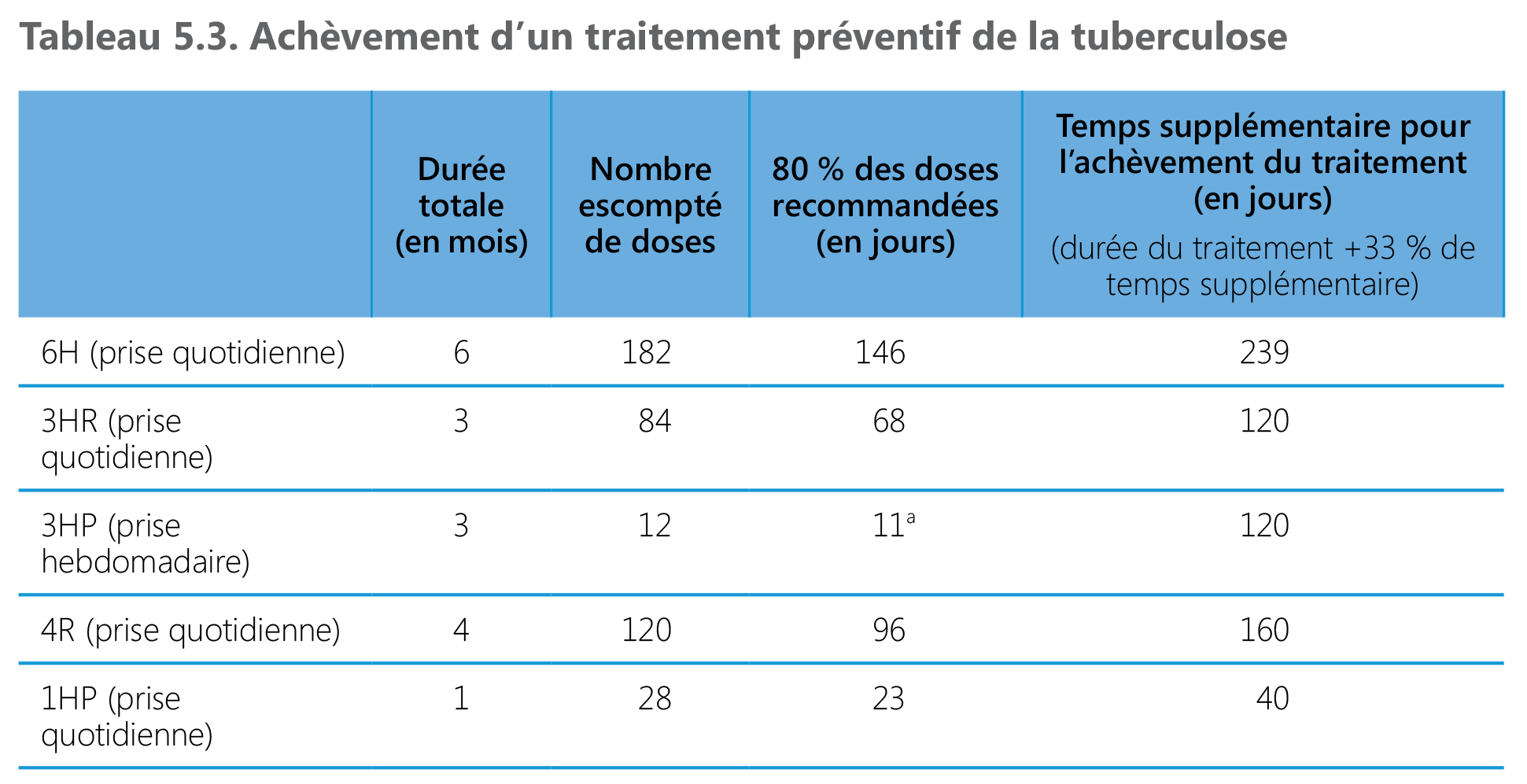
a : 90 % du nombre de doses recommandé.
Les programmes nationaux doivent adapter les dispositifs prévus pour améliorer l’observance des traitements aux besoins particuliers des groupes à risque et au contexte du pays. En règle générale, tous les protocoles de TPT peuvent être administrés efficacement par le patient lui-même. Il est peu probable que le TPT augmente le risque de sélection de mycobactéries pharmacorésistantes, au contraire du traitement de la tuberculose-maladie. Le mode d’administration du traitement et l’aide à son observance relèvent principalement de la préférence du patient. Les lignes directrices 2015 de l’OMS relatives aux TPT font apparaître des résultats hétérogènes avec des données peu concluantes sur les interventions destinées à améliorer l’observance et l’achèvement des traitements (73). Cependant, le compte de comprimés par les prestataires pour tous les sujets contacts de la personne sous TPT est peu coûteux et réalisable, et dans un essai clinique, cette méthode a donné une excellente valeur prédictive pour la réduction du risque de tuberculose (69) ; elle doit être intégrée à tous les services de TPT. De même, l’achat de produits conditionnés sous vide peut favoriser un meilleur suivi de l’observance comparé à des comprimés en flacons.
Les lignes directrices de l’OMS sur le traitement de la tuberculose pharmacosensible proposent plusieurs interventions visant à favoriser l’observance et pouvant aussi s’appliquer aux TPT (74). Ces interventions sont notamment le soutien par des réseaux de pairs, l’encadrement et l’éducation y compris des conseils sur la qualité et l’observation de traitements sous vidéo. Les programmes nationaux doivent allouer suffisamment de ressources humaines et financières pour renforcer les dispositifs d’observance des TPT et ne pas laisser les préoccupations sur l’observance, ou sur le manque d’outils favorisant l’observance, faire obstacle au déploiement des services de TPT.
Gestion des interruptions de traitements : il n’existe aucune recommandation étayée par des données probantes sur la façon de gérer l’interruption d’un TPT, c’est-à-dire comment rattraper les nombreuses doses manquées en prolongeant le traitement sans compromettre son efficacité. Le chapitre 7 présente un résumé des mesures proposées pour gérer les interruptions de traitements préventifs en s’appuyant sur la définition donnée plus haut à titre indicatif de l’achèvement d’un traitement préventif. Les programmes nationaux peuvent choisir entre une définition plus large ou plus stricte de l’achèvement d’un traitement (90 % des doses recommandées sur 120 % de la durée prévue du traitement ou 80 % des doses recommandées sur 133 % de la durée prévue du traitement ou une combinaison de ces deux définitions).
Outre la surveillance de l’achèvement du traitement (voir aussi le chapitre 8), un certain nombre de critères défavorables sont proposés qui permettraient de déclencher l’examen de la prise en charge d’un cas et, dans certaines circonstances, une modification du traitement (voir la liste ci-après).
• Échec – développement d’une tuberculose maladie à n’importe quel moment pendant la durée d’un TPT.
• Décès – décès pour une raison ou une autre, pendant la durée d’un TPT.
• Perdu de vue pour le suivi – TPT interrompu par le patient pendant huit semaines consécutives ou plus pour le protocole 6H, pendant quatre semaines consécutives ou plus pour les protocoles 3HP, 3HR et 4R, et pendant 10 jours consécutifs pour le protocole 1HP.
• Interruption d’un TPT pour raison de toxicité – par un clinicien à la suite de manifestations indésirables ou d’interactions médicamenteuses, avec ou sans reprise ou changement du traitement.
• Pas évalué – dossiers perdus, transfert à un autre établissement de santé avec enregistrement de l’achèvement du TPT.
Surveillance et soutien pendant un TPT
Les personnes sous TPT doivent bénéficier d’une surveillance à chaque contact avec le personnel soignant. Cette surveillance peut avoir lieu au moins une fois par mois ou plus souvent selon le besoin de soins des personnes sous TPT ou conformément aux dispositions de la politique nationale. Le personnel infirmier et d’autres agents de santé intervenant en première ligne dans une zone périphérique peuvent être formés à la surveillance d’un TPT et décider s’il doit être modifié en raison de manifestations indésirables ou repris (par exemple après une interruption par la personne sous traitement). Normalement, il n’est pas indispensable que ces décisions soient prises par des médecins ou des spécialistes mais ils doivent être prêts à intervenir si nécessaire.
Autrement, la surveillance doit concorder avec les dispositifs du modèle de prestation de services différenciée pour les personnes vivant avec le VIH lorsqu’il est appliqué, ou avec le calendrier d’obtention d’autres médicaments (comme des ARV). En principe, en définissant le calendrier des visites de suivi ou d’obtention des médicaments, il faut considérer comme essentiel qu’il convienne à la personne. Il est important de respecter la décision prise par une personne, en toute connaissance de cause, de ne pas prendre le TPT qu’on lui propose ou de l’interrompre après l’avoir commencé. Les personnes ne doivent pas se sentir forcées à prendre un traitement (voir aussi les principes éthiques dans le chapitre 9). Lors de chaque contact avec la personne recevant le TPT, le prestataire doit :
• lui faire mieux comprendre les symptômes de la tuberculose-maladie, les raisons du TPT et l’importance de l’achèvement du traitement.
• vérifier la présence de signes ou de symptômes de tuberculose-maladie ; et si elle est diagnostiquée, le TPT doit être interrompu et un traitement curatif antituberculeux doit commencer.
• peser la personne si possible et ajuster la posologie en conséquence. Ce point est particulièrement important pour les jeunes enfants puisqu’en pleine croissance, il est normal que le nourrisson et le jeune enfant prennent rapidement du poids pendant la période couverte par le TPT et il est donc indispensable d’ajuster la posologie du traitement. Par ailleurs, une perte de poids justifiée ou l’incapacité à s’épanouir est un premier indicateur clinique d’une tuberculose-maladie.
• rechercher des manifestations indésirables dues aux médicaments et prendre en charge tout effet de toxicité identifié ou orienter le patient vers un service de soins spécialisés si nécessaire.
• rappeler à la personne sous TPT qu’elle doit contacter un agent de santé ou un prestataire si elle constate des manifestations indésirables telles que : anorexie, nausées, vomissements, gêne abdominale, fatigue chronique ou faiblesse, urines foncées, selles décolorées ou ictère. Ces manifestations sont évocatrices d’une atteinte hépatique et nécessitent un examen urgent. Si un soignant ne peut pas être consulté dès l’apparition des symptômes, il faut alors conseiller à la personne sous TPT d’arrêter le traitement immédiatement.
• Se faire expliquer pour quelles raisons une dose a été omise et intensifier l’aide nécessaire pour permettre à l’avenir l’observance du TPT.
• Poursuivre la prise en charge des comorbidités et obtenir si nécessaire une consultation avec le médecin traitant.
• Demander à la patiente si elle est enceinte, allaitante ou si elle utilise une contraception.
• Enregistrer la visite, la prise de médicaments et les conclusions en utilisant les informations des dossiers individuels ou des formulaires exigés par le programme national.
Point important : À chaque occasion, les prestataires administrant le TPT doivent rappeler aux bénéficiaires l’éventualité de manifestations indésirables et mettre à nouveau l’accent sur les signes et symptômes qui doivent les inciter à contacter le personnel soignant et/ou à interrompre le TPT.
Prestation de service différenciée (DSD) pour la prise en charge du VIH et implications pour le déploiement du TPT
Les pays confrontés à une lourde charge d’infection à VIH, en particulier en Afrique sub-saharienne, intensifient progressivement le déploiement de prestations de service différenciées pour la prise en charge du VIH. Les modèles de DSD pour les bénéficiaires des soins du VIH jugés stationnaires, sont centrés sur la personne et ont pour but de faire passer les personnes dont le traitement se déroule bien à des modèles moins intensifs nécessitant moins de visites aux établissements de santé. Les modèles de prestation différenciée de services de la tuberculose peuvent être modifiés pour tenir compte des différents besoins des personnes vivant avec le VIH, quel que soit leur âge. Ils peuvent aussi être étendus aux populations indemnes d’infection à VIH qui se trouvent exposées à un risque accru de contracter une tuberculose-maladie, notamment les sujets qui sont des contacts domestiques de patients tuberculeux.
Différents modèles de prestations différenciées de TARV ont récemment fait l’objet d’essais, y compris les modèles concernant les groupes gérés par des agents de santé ; les modèles pilotés par des personnes recevant un TPT ; les modèles pour patients en établissements et les modèles appliqués dans la communauté. Quelques exemples de modèles de prestations de services différenciées mis en application (75,76) sont présentés ci-après.
• Espacement des rendez-vous (modèle pour patient en établissement) : prescriptions pour plusieurs mois et circuit rapide organisé dans les établissements à forte fréquentation pour permettre aux patients jugés stationnaires d’obtenir rapidement un bilan et de se rendre directement à la pharmacie pour recueillir leurs médicaments.
• Points de distribution de TARV dans la communauté (modèles appliqués dans la communauté) : le dépistage et la distribution de médicaments sont assurés par des agents de santé non professionnels.
• Clubs d’observance (dans les établissements et dans la communauté) : distribution de traitements à l’occasion de réunions de groupes de soutien (tous les trois à six mois).
• Services spécialisés adaptés aux enfants fournissant des TPT et des TARV pour une durée de 2 à 8 semaines, selon les dates prévues de déplacement de chaque bénéficiaire.
• Collecte pour des zones isolées auprès de pharmacies privées ou distributeurs automatiques de médicaments sans aucune intervention des agents de santé communautaires.
• Les prestations différenciées de services aux personnes vivant avec le VIH jugées stationnaires devraient normalement réduire la grande affluence dans les services dispensant les TARV, améliorer la qualité des soins, améliorer l’observance et les taux de suppression de la charge virale et enfin rendre l’accès à ces services plus commode pour les usagers. Les prestations de services différenciées devraient normalement permettre un soutien approprié et une sensibilisation aux manifestations indésirables possibles, à la faculté des médicaments à être bien tolérés et à l’importance du bon achèvement d’un traitement. En principe, tous les services recommandés de la tuberculose doivent être intégrés à ces modèles de prestation de services et il faut tirer parti des dispositifs existants de contrôle de la qualité de services de TARV pour suivre la mise en oeuvre de la détection intensifiée des cas de tuberculose et des services de TPT. Les interventions suivantes doivent être envisagées pour les soins de la tuberculose dans le cadre des programmes de prestations différenciées de services.
• Tous les services recommandés de la tuberculose et/ou du VIH proposés aux personnes vivant avec le VIH (notamment le dépistage régulier de la tuberculose, l’orientation des personnes vers des services de diagnostic lorsque l’on constate des symptômes de la tuberculose et un TPT si l’on a écarté une éventuelle tuberculose-maladie) doivent être dispensés à intervalles réguliers (au moins une fois par trimestre).
• Un TPT peut commencer durant un examen pré-TARV ou avant de commencer à espacer les rendez-vous selon le principe des prestations de services différenciées, en particulier pour les protocoles thérapeutiques plus courts (1HP) ou pendant les visites de suivi au centre de santé si des protocoles plus longs (6H, 4R, 3HR, 3HP) sont mis en place conformément aux directives nationales.
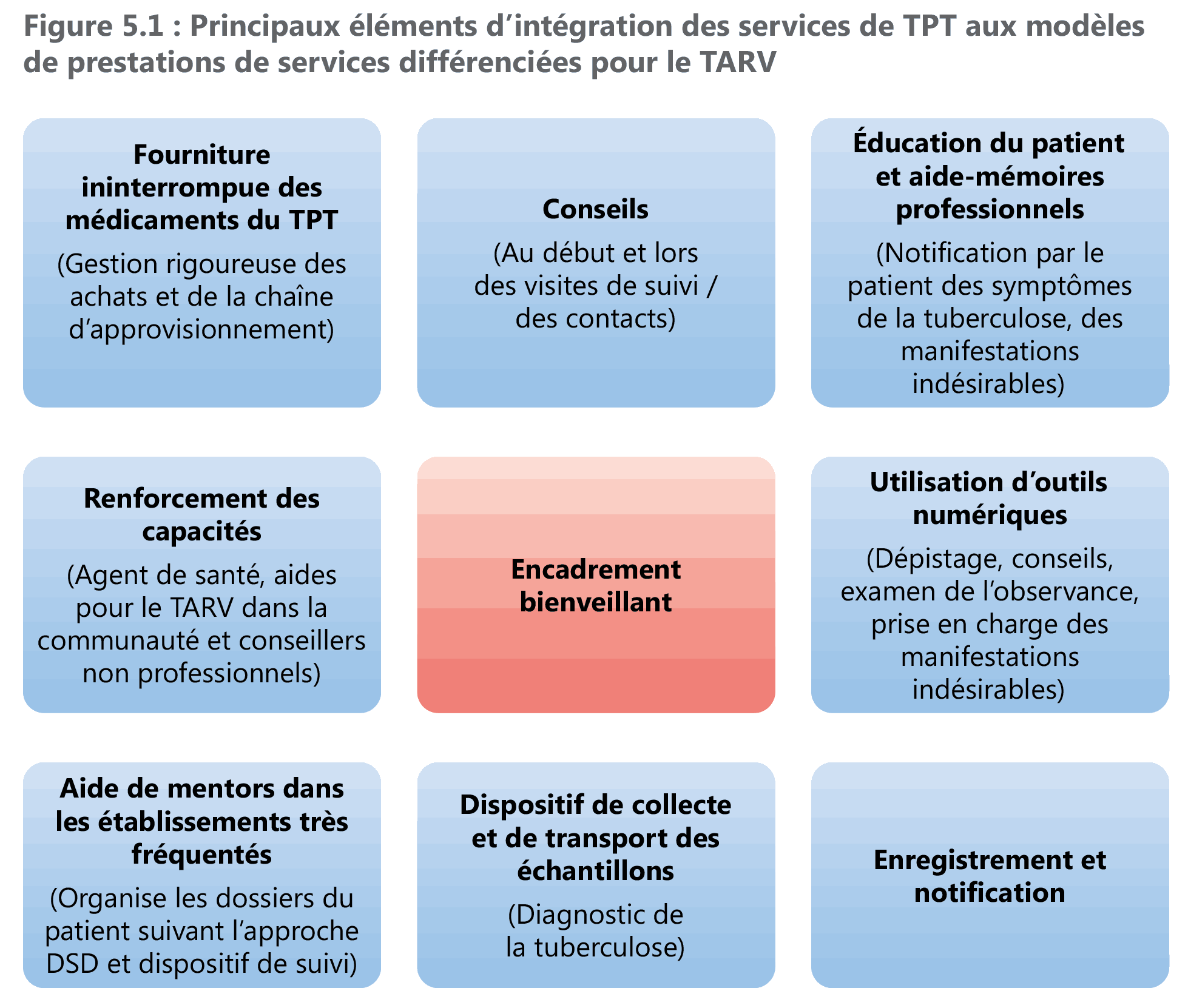
Si les protocoles de TPT, quelle que soit leur longueur, peuvent être dispensés sur les principes des prestations différenciées des services, il est indispensable d’instaurer un dispositif pour identifier et prendre en charge une manifestation indésirable en tenant compte de la durée des protocoles de TPT et en justifiant systématiquement les indicateurs de TPT (voir le chapitre 8). La Figure 5.1 décrit les principaux éléments d’intégration des TPT dans les initiatives de prestation de service différenciée.
Alors que davantage de pays appliquent la méthode de prestation de service différenciée, une opportunité importante de déployer plus largement les services de TPT se présente lorsqu’un pays décide de passer à un TARV contenant du dolutégravir (ou autres nouveaux protocoles). Plusieurs pays d’Afrique de l’Est et du Sud ont décidé de s’aligner sur le protocole contenant une triple association (ténofovir, lamivudine, dolutégravir) avec le déploiement de protocoles de TPT plus courts (3HP). Le passage à un nouveau TARV impliquant un suivi clinique plus fréquent, les programmes nationaux tirent parti aussi de cette opportunité pour commencer un TPT et acquérir une expérience de son application pour orienter le déploiement à l’échelon national.
Point important : La prestation différenciée de services du VIH est étendue aux services de TARV. La détection intensifiée des cas de tuberculose et les TPT doivent être intégrés à ces modèles. L’instauration de prestations différenciées de services ne doit pas être une raison de retarder ou de nier les bienfaits d’un TPT pour les personnes vivant avec le VIH. En fait, les visites des patients doivent être programmées de telle façon qu’ils puissent passer prendre les médicaments de leur TARV et de leur TPT en même temps.
Services de TPT aux populations particulières
Le TPT pour les femmes enceintes ou en postpartum
Les femmes enceintes vivant avec le VIH sont exposées à un risque plus élevé de tuberculose pendant leur grossesse et dans la période du postpartum, ce qui peut avoir de graves conséquences tant pour la mère que pour le nourrisson (77,78). Une grossesse ne doit pas empêcher les femmes vivant avec le VIH ou les femmes enceintes négatives pour le VIH et admissibles, de bénéficier d’un TPT puisque l’isoniazide et la rifampicine, les médicaments constituant généralement le traitement préventif, sont considérées pouvoir être utilisées sans risque en cas de grossesse (classé dans la catégorie C Grossesse par la Food and Drug Administration des États-Unis) (79,80). L’OMS a réalisé un examen systématique pour la mise à jour 2019 des lignes directrices relatives à l’infection tuberculeuse latente en vue d’évaluer les données factuelles confirmant ou infirmant le rapport récent d’un essai contrôlé randomisé faisant apparaître le risque d’effets préjudiciables d’un TPI sur une grossesse (81). Toutefois, l’examen de toutes les autres données probantes existantes n’a pas établi le même lien entre un TPI et des effets préjudiciables sur une grossesse, tels qu’une mort in utero/néonatale, une prématurité, un faible poids de naissance ou une anomalie congénitale. De même, aucun risque hépatotoxique maternel significatif d’un point de vue statistique, ni des manifestations de grade 3 ou 4 ni des décès n’ont été notifiés. C’est pourquoi il n’est sans doute pas nécessaire de reporter le TPT en période du postpartum ; il doit commencer pendant les périodes prénatales et postnatales, parallèlement aux soins nécessaires. Un test systématique de la fonction hépatique n’est pas indiqué lorsqu’un TPT est administré pendant une grossesse, sauf s’il existe d’autres risques. La supplémentation en vitamine B6 doit être administrée systématiquement à toutes les femmes enceintes et allaitantes recevant un TPT. La rifampicine est généralement considérée sans risque pendant une grossesse et il n’est pas nécessaire d’ajuster la dose, même si l’on ne dispose d’aucune donnée sur son innocuité ou son efficacité, particulièrement pour les femmes enceintes ou en postpartum. (82). Peu de données existent sur l’efficacité et l’innocuité de la rifapentine en cas de grossesse et de ce fait, les protocoles 1HP et 3HP ne doivent pas être adoptés en cas de grossesse tant que l’on n’aura pas obtenu davantage de données sur leur innocuité.8 Jusque-là, la triple association isoniazide, cotrimoxazole et vitamine B6 peut être utilisée dans le TPT pour des femmes enceintes ou en postpartum infectées par le VIH, accompagnée des soins nécessaires de soutien et d’une surveillance.
Le traitement préventif à l’isoniazide et/ou à la rifampicine peut être administré sans risque aux femmes qui allaitent (83). Un supplément de pyridoxine (vitamine B6) doit être donné au nourrisson sous isoniazide ou dont la mère qui l’allaite est sous isoniazide. Comme pour les femmes enceintes vivant avec le VIH, la triple association isoniazide, cotrimoxazole et vitamine B6 peut être administrée aux femmes allaitantes, infectées par le VIH.
Point important : La triple association isoniazide, cotrimoxazole et vitamine B6 peut être l’option préconisée pour le TPT dans le cas de femmes enceintes ou en postpartum infectées par le VIH et ce, jusqu’à ce que l’on dispose d’un plus grand nombre de données sur l’innocuité de la rifapentine dans des protocoles plus courts.
Femmes prenant des contraceptifs oraux ou hormonaux
La rifampicine et la rifapentine interagissent avec les contraceptifs oraux et hormonaux, ce qui risque de rendre ces derniers moins efficaces. Les femmes sous contraceptifs oraux qui prennent de la rifampicine ou de la rifapentine doivent soit :
• changer de contraceptif oral et utiliser une variante (telle que l’acétate de médroxyprogestérone-retard (DMPA) toutes les huit semaines (84) ou une plus forte dose d’oestrogène (50 μ)) sur consultation d’un clinicien ; ou
• choisir une autre forme de contraception, un contraceptif « barrière » ou un dispositif intra-utérin.
Chez les femmes porteuses d’implants contraceptifs, il peut être nécessaire de diminuer la fréquence de remplacement des implants, de 12 à 8 semaines (Étude ACTG A5338).
Maladie hépatique ou antécédent de maladie hépatique
L’isoniazide et la rifampicine/rifapentine sont associées à une atteinte du foie. Le TPT doit être lancé avec précaution chez les personnes dont les valeurs de référence des transaminases hépatiques sont connues et sont plus de trois fois supérieures à la limite supérieure des valeurs normales. Il ne faut pas administrer de traitement préventif à des personnes atteintes d’une maladie hépatique au stade terminal. Toutefois, on sait qu’un TPI est bien toléré chez les personnes atteintes des formes chroniques de l’hépatite B ou de l’hépatite C (85,86).
Hépatite aiguë (et hépatite virale aiguë)
Reporter le traitement préventif jusqu’à guérison de l’hépatite aiguë.
Insuffisance rénale
L’isoniazide et la rifampicine/rifapentine sont éliminées par excrétion biliaire. Toutefois, ces médicaments, peuvent être administrés par doses standard aux patients souffrant d’insuffisance rénale. Les patients souffrant d’une forme grave de l’insuffisance rénale doivent recevoir l’isoniazide simultanément avec la pyridoxine (vitamine B6) pour prévenir une neuropathie périphérique.
Personnes vivant avec le VIH
Une difficulté majeure avec le protocole de TPT contenant un médicament de la classe des rifamycines administré aux personnes vivant avec le VIH est l’interaction médicamenteuse. Il n’est pas nécessaire d’ajuster les doses lorsque la rifapentine ou la rifampicine sont administrées simultanément avec l’éfavirenz. Lorsque le dolutégravir est administré simultanément avec de la rifampicine, sa dose doit être augmentée et portée à 50 mg deux fois par jour (pas d’ajustement de dose nécessaire lorsqu’il est administré avec de la rifapentine). Les protocoles de TPT contenant de la rifampicine ou de la rifapentine ne doivent pas être administrés simultanément avec des inhibiteurs de la protéase ou de la névirapine (pour plus de détails, voir le chapitre sur les interactions médicamenteuses).
Prise en charge de nourrissons nés de mères tuberculeuses
• Examiner le nouveau-né. S’il ne va pas bien, l’orienter vers un spécialiste et/ou un pédiatre. Il est important de s’assurer que la mère reçoive un traitement antituberculeux efficace pour qu’elle cesse d’être contagieuse. De plus, faire en sorte que les mesures de lutte anti-infectieuse soient en place dans la maternité, surtout si le nourrisson se trouve hospitalisé pour des soins parce qu’il est prématuré ou de petite taille à la naissance.
• Si le nouveau-né va bien (absence de tous signes ou symptômes évocateurs de tuberculose), administrer un TPT et reporter la vaccination par le BCG (bacille Calmette et Guérin) jusqu’à l’achèvement du TPT. Administrer la pyridoxine à raison de 5 à 10 mg par jour.
• Si le nourrisson est exposé au VIH (sa mère est infectée par le VIH) et sous névirapine, alors il convient de commencer un traitement préventif à l’isoniazide. Un TPT avec les protocoles RH et HP ne peut pas être administré simultanément avec une dose prophylactique de névirapine puisque la rifamycine diminue les concentrations de névirapine et peut favoriser la transmission mère-enfant du VIH (87).
• À la fin du TPT, procéder à un test TCT ou IGRA. Si le test de dépistage de l’infection tuberculeuse est négatif ou non disponible, administrer le BCG (à moins que le nourrisson soit positif pour le VIH).
• Si la mère prend un traitement antituberculeux, elle peut sans risque continuer à allaiter. La mère et l’enfant doivent rester ensemble et le nourrisson peut être nourri au sein tout en étant sous TPT.
• Lorsqu’un nourrisson est nourri au sein d’une mère sous traitement antituberculeux ou sous TPT, on doit lui administrer de la pyridoxine pendant toute la durée du traitement de sa mère.
Sujets contacts de patients atteints de tuberculose MR
Les sujets qui sont des contacts domestiques de patients atteints de tuberculose MR ou monorésistante à l’isoniazide sont exposés à un risque plus élevé d’infection tuberculeuse que les sujets contacts exposés à une tuberculose pharmacosensible. Cependant, le risque d’évolution vers une tuberculosemaladie est le même dans les deux groupes de sujets contacts (88). Des études ont permis de conclure à une baisse d’environ 90 % de l’incidence des cas de tuberculose MR après un TPT (89). L’OMS recommande l’administration d’un TPT aux sujets en contact avec des patients présentant une tuberculose MR après avoir évalué l’intensité de l’exposition, confirmé le cas source et son mode de résistance aux médicaments (par exemple tuberculose MR confirmée bactériologiquement et sensibilité avérée à une fluoroquinolone) et vérifié l’infection tuberculeuse au moyen d’un test IGRA ou TCT. Le but est d’éviter de possibles manifestations indésirables dues à l’utilisation d’une fluoroquinolone pendant six mois et de préserver l’option qui consiste à utiliser une fluoroquinolone dans l’éventualité où des sujets contacts seraient atteints de tuberculose-maladie multirésistante.
L’OMS suggère la prise de lévofloxacine pendant six mois (formulation pédiatrique pour les enfants contacts) (voir la posologie dans le Tableau 5.2) simultanément avec d’autres antituberculeux tels que l’éthionamide ou l’éthambutol s’ils sont bien tolérés. Que le traitement soit administré ou non, un suivi clinique doit être effectué pendant deux ans et tout signe et symptôme émergeant évocateur de tuberculose doit faire l’objet d’une enquête active et des traitements curatifs doivent être lancés si nécessaire. Les sujets contacts de personnes atteintes de tuberculose résistante à la rifampicine peuvent être traités, tout comme les sujets contacts de patients atteints de tuberculose MR, mais si la sensibilité à l’isoniazide est confirmée chez les cas index, leurs sujets contacts peuvent recevoir les protocoles thérapeutiques 6H/9H. Pour les sujets en contact avec des personnes atteintes de tuberculose dont la résistance à l’isoniazide est avérée, il existe peu de données probantes pouvant étayer le choix des protocoles de TPT. Toutefois, selon des données du Pérou, un TPI est toujours efficace (88). En outre, dans de telles situations, le protocole 4R peut être une option pour le TPT.
Des essais contrôlés randomisés sur le traitement préventif de la tuberculose MR doivent être réalisés d’urgence pour améliorer la base de données factuelles. Les résultats des trois essais contrôlés randomisés suivants sur les TPT administrés à des sujets qui sont des contacts domestiques de patients atteints de tuberculose MR devraient normalement être disponibles au cours des prochaines années :
• TB CHAMP : essais pendant six mois de traitement par la lévofloxacine (Lfx) contre placebo sur des nourrissons et de jeunes enfants de moins de cinq ans exposés à une tuberculose MR (Afrique du Sud ; recrutement en cours et publication des résultats prévue avant fin 2021 ; http://www.isrctn.com/ISRCTN92634082).
• V-QUIN : essais pendant 24 semaines de traitement par la lévofloxacine (Lfx) contre placebo sur des sujets de tous âges avec infection manifeste (Viet Nam ; recrutement terminé ; fin de la collecte des données en mars 2022 ; https://anzctr.org.au/Trial/ Registration/TrialReview.aspx?id=369817).
• PHOENIx : essais pendant 26 semaines de traitement par la délamanide contre isoniazide sur des sujets de tous âges (11 pays ; selon les estimations, achèvement terminé mi-2025; https://clinicaltrials.gov/ct2/show/NCT03568383).
Le TPT et le traitement contre le virus de l’hépatite C (VHC)
La rifamycine et la rifapentine ne sont pas recommandées pour une prise simultanée avec de nombreux TARV à action directe destinés à traiter le VHC, puisque la rifamycine peut réduire les concentrations d’anti-VHC à des niveaux sous-thérapeutiques (90,91). Les personnes infectées par le VHC doivent consulter leurs prestataires de soins de santé et commencer un TPT à base de rifamycine, avant ou après l’achèvement du traitement contre le VHC.
Le TPT et les consommateurs de drogues
La prévalence de l’infection tuberculeuse et l’incidence des cas de tuberculose-maladie sont plus élevées chez les consommateurs de drogues (92). La rifapentine n’a pas fait l’objet d’études systématiques auprès des consommateurs de drogues. Cependant, la rifampicine est connue pour réduire les expositions aux thérapies de substitution aux opioïdes comme la méthadone et la buprénorphine (93). Chez certaines personnes, il en résulte un sevrage aux opiacés. Pour cette raison, les personnes sous protocoles thérapeutiques 3HP, 3HR ou 4R avec thérapies de substitution aux opioïdes doivent être suivies de près pour identifier des signes de sevrage aux opiacés et d’autres manifestations indésirables. Augmenter la dose de méthadone ou de buprénorphine en prenant de la rifamycine peut réduire le risque de sevrage. Le traitement préventif à l’isoniazide peut être utilisé sans risque par les consommateurs de drogues, mais il est important de surveiller étroitement une éventuelle hépatotoxicité (94). La consommation de drogues ne doit jamais servir de prétexte pour refuser un TPT à quelqu’un. Il est de la responsabilité des prestataires de soins de santé d’anticiper la prise en charge, sans risque, des interactions médicamenteuses pour les consommateurs de drogues (95).
⁴ Voir le texte et le Tableau 5.2 pour des options de TPT dans les cas de tuberculose à bacilles multirésistants (Tuberculose MR).
⁵ Prix obtenus à partir des prix de référence du STBP/GDF et des catalogues du Fonds mondial– Stichting I+solutions, les fournisseurs du Fonds mondial dont la qualité est assurée, la IDA Foundation et le Partenariat pour la gestion de la chaîne d’approvisionnement http://www.stoptb.org/assets/documents/gdf/20191015%20GDF%20TB%20Medicines%20Budgeting%20Prices.pdf).
⁶ Données issues de l’essai clinique NCT02651259, Évaluation de la pharmacocinétique, de la tolérance et de l’innocuité d’un traitement par association de rifapentine + isoniazide pris une fois par semaine chez les femmes enceintes ou en postpartum infectées par le VIH-1 et non infectées par le VIH-1 présentant une infection tuberculeuse latente, résultats qui doivent être présentés à la Conférence sur les rétrovirus et les infections opportunistes, en 2020.
⁷ L’isoniazide est métabolisée par la N-acétyltransférase 2 (NAT2) et une mutation du génotype de la NAT2 entraîne une persistance de l’isoniazide dans l’organisme et prédispose celui-ci à l’hépatotoxicité. La prévalence des mutations de NAT2 diffère selon les zones géographiques, les acétyleurs lents (connus pour être à risque d’hyper toxicité d’origine médicamenteuse) étant très courants dans certains pays (83 % en Égypte et 67 % aux États-Unis d’Amérique) mais plus rares dans d’autres pays (12 % en Chine).
⁸ Étude IMPAACT de 2001 dont les conclusions doivent être présentées à la Conférence de 2020 sur les rétrovirus et les infections opportunistes, et montrent la pharmacocinétique et l’innocuité relative du protocole 3HP dans le cas de femmes enceintes mais soulignent la nécessité de procéder à d’autres études.
 Retour
Retour