Liens transversaux de livre pour 3.3 Remarks
Le GDG 2018 a évalué la contribution individuelle aux résultats des patients des médicaments utilisés dans les schémas plus longs contre la tuberculose MR en utilisant principalement les estimations de l’effet de la méta-analyse des DIP 2018 et de l’essai 213 (délamanide) pour la question PICO 3-2018 (tuberculose MR-RR, 2018 (voir Annex 3 pour les résumés des données GRADE respectifs pour chaque médicament et Annex 4 pour le tableau décisionnel). Suite à une évaluation approfondie des avantages et des inconvénients relatifs, des recommandations ont été formulées pour chaque médicament, avec un classement en trois groupes (voir les Tableaux 3.1, 3.2 et 3.3).
- Groupe A : les fluoroquinolones (lévofloxacine et moxifloxacine), la bédaquiline et le linézolide ont été considérés comme très efficaces et fortement recommandés pour l’inclusion dans tous les schémas, sauf contre-indication.
- Groupe B : la clofazimine et la cyclosérine ou la térizidone ont été recommandées de façon conditionnelle comme produits de deuxième choix.
- Groupe C : sont inclus tous les autres médicaments qui peuvent être utilisés lorsqu’un schéma ne peut pas être composé avec des produits du groupe A et B. Les médicaments du groupe C sont classés par l’équilibre relatif de l’avantage par rapport à l’inconvénient généralement attendu pour chacun d’entre eux.
Les autres médicaments qui ne sont pas inclus dans les groupes A–C sont les suivants :
- la et la capréomycine, qui étaient associés à de moins bons résultats lorsqu’elles étaient utilisées et qui de ce fait ne sont plus recommandées pour les schémas de tuberculose MR ;
- la gatifloxacine, l’isoniazide à forte dose et la thioacétazone – la gatifloxacine et l’isoniazide à forte dose ont été utilisés chez très peu de patients et la thioacétazone n’a pas été utilisée du tout. Les préparations de gatifloxacine de qualité garantie ne sont actuellement pas disponibles suite à leur retrait du marché en raison de préoccupations au sujet des dysglycémies. Il est peu probable que la thioacétazone ait un rôle dans les schémas contemporains plus longs et elle n’est actuellement pas disponible dans une formulation de qualité garantie. L’isoniazide à forte dose peut avoir un rôle chez les patients présentant une sensibilité confirmée à l’isoniazide (voir Section 3.4).
- l’acide clavulanique – ce médicament devrait être inclus dans les schémas MR-RR uniquement en tant que complément aux carbapénèmes (imipénème-cilastatine et méropénème). Utilisé de la sorte, il doit être administré à chaque dose de carbapénème et ne doit pas être considéré comme un autre antituberculeux efficace.
Aucune recommandation sur le perchlozone, l’interféron gamma ou le sutézolide n’a pu être formulée du fait de l’absence de données finales sur les résultats thérapeutiques des patients issues d’études appropriées auprès des patients.
En ce qui concerne l’utilisation de la bédaquiline chez les patients de moins de 18 ans et considérant que les profils exposition– réponse (efficacité) peuvent être extrapolés des adultes aux enfants, le GDG a conclu que les doses évaluées chez les enfants et les adolescents dans deux essais (Essai de phase 2 TMC207-C211 et Phase 1-2 IMPAACT P1108 ; voir Annex 5) ne semblent pas indiquer d’expositions qui augmenteraient les risques d’échec thérapeutique chez les patients âgés de 6 à 17 ans. Le risque de sécurité chez les enfants de 6 ans et plus recrutés dans les essais – qui étaient tous VIH-négatifs et peu exposés à d’autres médicaments associés à l’allongement de l’intervalle QT – ne semblait pas supérieur à celui des adultes. La variabilité observée dans la taille limitée de l’échantillon empêchait tout commentaire sur l’exposition-réponse (sécurité). Le GDG 2018 a également conclu que les considérations relatives au bénéfice-risque pour l’utilisation de la bédaquiline chez les patients âgés de 6 à 17 ans sont semblables à celles des adultes, mais il a souligné la nécessité d’obtenir plus de données avant d’envisager de qualifier cette recommandation de forte.
L’examen du GDG en 2021 a permis de conclure que l’équilibre entre les effets souhaitables et les effets indésirables était probablement en faveur d’une utilisation de la bédaquiline chez les enfants âgés de moins de 6 ans. Le GDG 2021 a souligné que les avantages peuvent varier en fonction de contextes particuliers et des caractéristiques de la population concernée, par exemple de son état nutritionnel. Il a ajouté que le coût potentiellement plus élevé de la bédaquiline dans un schéma thérapeutique utilisé pour le traitement de la tuberculose MR-RR devait être mis en regard des avantages des schémas thérapeutiques plus courts sans injection (ce qui signifie moins de déplacements, moins de temps passé dans les services de consultation et moins d’événements indésirables). En outre, il a estimé que l’utilisation de la bédaquiline chez les jeunes enfants pourrait améliorer l’équité, car celle-ci devrait être acceptable pour la majorité des parties prenantes, et que l’un des principaux éléments de faisabilité serait lié à la nécessité d’assurer une surveillance de son innocuité (accès à une surveillance par ECG, et capacité du personnel à effectuer cette surveillance). Le groupe d’experts a toutefois estimé que l’utilisation de la bédaquiline chez les jeunes enfants était probablement réalisable.
En ce qui concerne l’utilisation du délamanide chez les enfants de moins de 6 ans, le GDG 2018 a décidé que, sur la base des résultats obtenus chez les adultes et des données pharmacologiques et d’innocuité examinées, les extrapolations sur l’efficacité et l’innocuité devaient être limitées aux enfants âgés de 3 à 5 ans, mais pas aux enfants de moins de 3 ans (voir Web Annex 5). Les profils d’exposition chez les enfants de 3 à 5 ans étaient comparables à ceux des adultes et n’étaient pas supérieurs à ceux des enfants de 6 ans et plus, pour lesquels les précédents GDG convoqués par l’OMS avaient déjà recommandé l’utilisation du délamanide (10, 64). D’après les données cardiaques et de laboratoire fournies, aucun signal de sécurité différent de ceux signalés chez les adultes n’a été observé chez les enfants âgés de 3 à 5 ans. Le GDG s’inquiétait néanmoins de la faisabilité d’administrer la dose correcte à des enfants âgés de 3 à 5 ans, compte tenu du fait que la formulation particulière utilisée dans l’essai (25 mg) ne serait pas disponible dans un avenir proche et que seul le comprimé adulte (50 mg) est disponible, qui n’est pas bioéquivalent et dont le contenu est difficile à manipuler sans compromettre son efficacité.
L’examen du GDG en 2021 a permis de conclure que l’équilibre entre les effets souhaitables et les effets indésirables était probablement en faveur d’une utilisation de la bédaquiline chez les enfants âgés de moins de 6 ans. Le GDG 2021 a également déclaré que les implications en termes de ressources pourraient varier avec la probable future mise à disposition du comprimé dispersible de 25 mg. Il a été estimé que les schémas thérapeutiques plus longs contenant du délamanide pourraient permettre d’accroître l’équité et être acceptables pour les parties prenantes. En outre, le GDG a jugé qu’il serait probablement possible d’utiliser le délamanide chez les enfants, quel que soit leur âge, d’autant plus que la formulation adaptée aux enfants devrait être disponible courant 2021 (elle est aujourd’hui disponible). Cet avis a également pris en compte le fait que les comprimés pour adultes ne peuvent pas, sans risquer d’altérer la biodisponibilité, être divisés, écrasés ou dissous pour faciliter leur administration aux enfants.
Suite aux multiples examens au fur et à mesure de la disponibilité de nouvelles données, l’utilisation de la bédaquiline et du délamanide n’est plus limitée par l’âge du patient.
Tableau 3.1. Groupes de médicaments dont l’utilisation est recommandée dans les schémas plus longs de la tuberculose MRᵃ
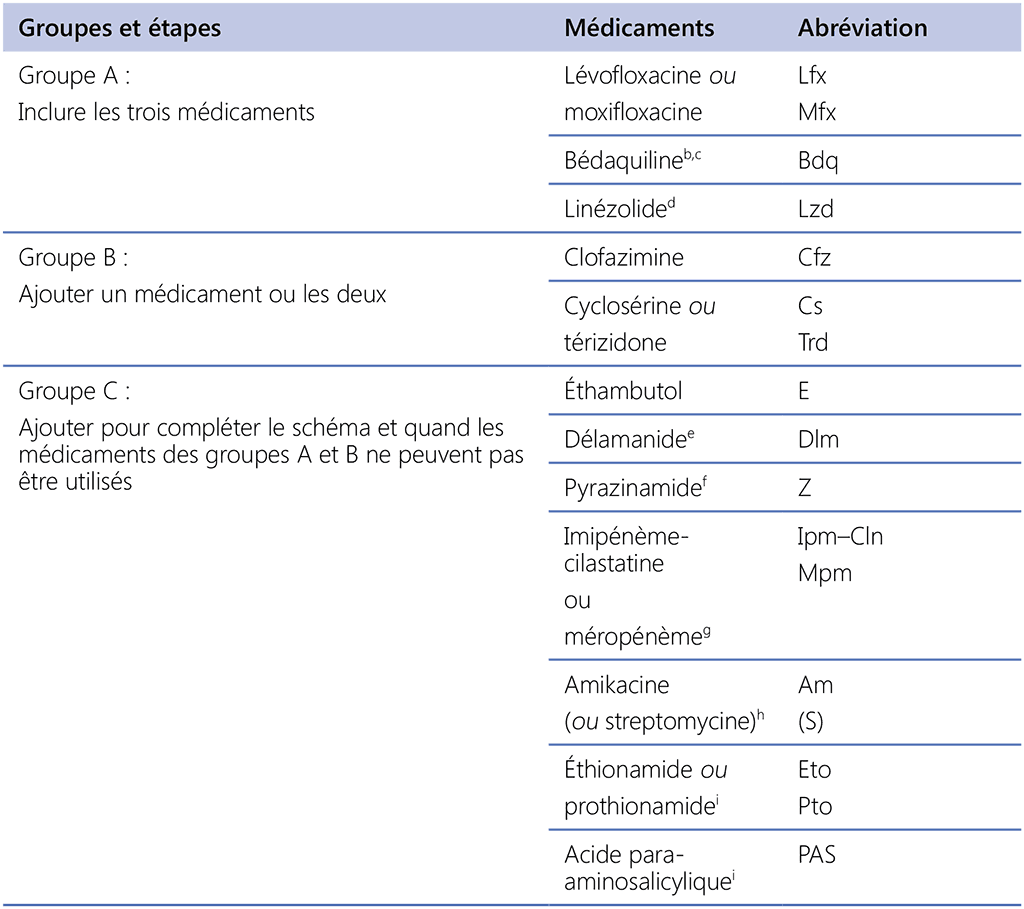

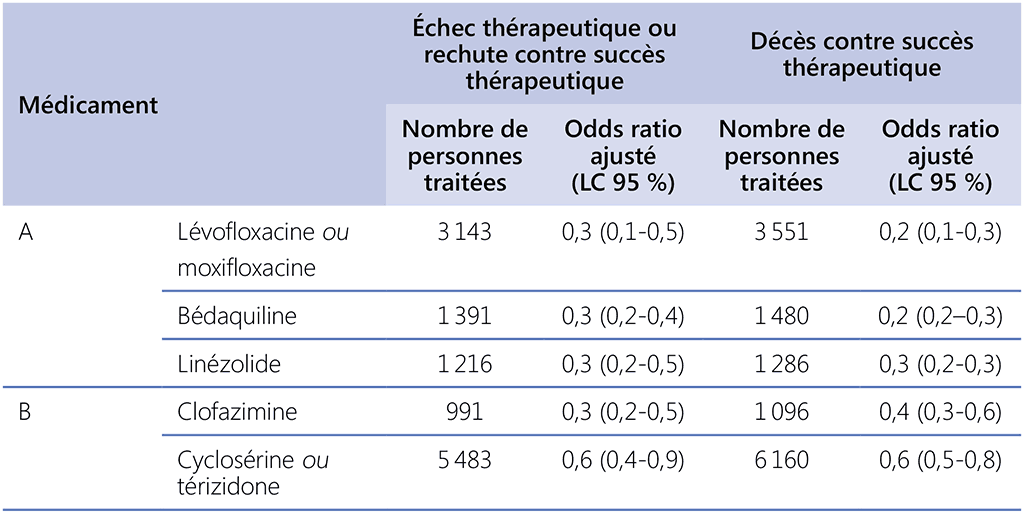
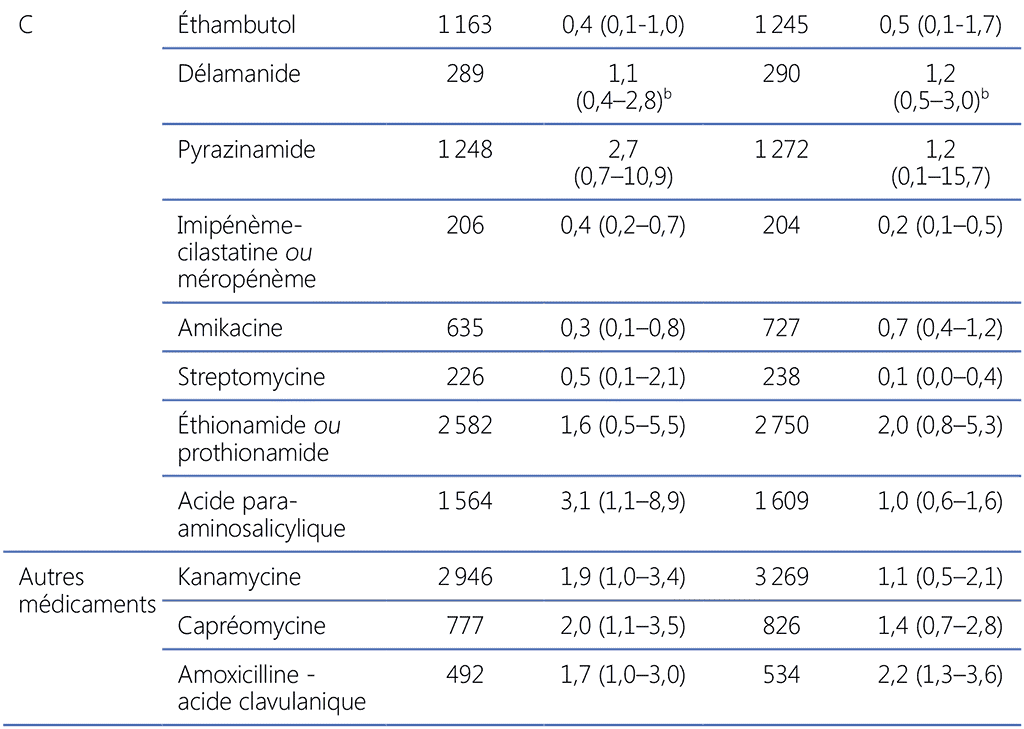
Tableau 3.2. Risque relatif pour échec thérapeutique ou rechute et décès (contre succès thérapeutique), méta-analyse des DIP 2018 pour les schémas plus longs de la tuberculose MR et essai 213 sur le délamanide (population en intention de traiter)ᵃ
Question PICO 4-2018 (tuberculose MR-RR, 2018) (nombre de médicaments susceptibles d’être efficaces).
En ce qui concerne la question PICO 4 (tuberculose MR-RR, 2018), l’analyse a révélé que dans les schémas thérapeutiques plus longs de la tuberculose MR, le risque d’échec thérapeutique, de rechute et de décès était comparable lorsque le traitement débutait avec quatre, cinq ou six médicaments susceptibles d’être efficaces. Elle a également montré que les patients qui prenaient trois médicaments dans la phase de continuation – situation attendue avec quatre médicaments au début et arrêt du produit injectable à la fin de la phase intensive – n’obtenaient pas de moins bons résultats que ceux qui prenaient quatre médicaments dans la phase de continuation.
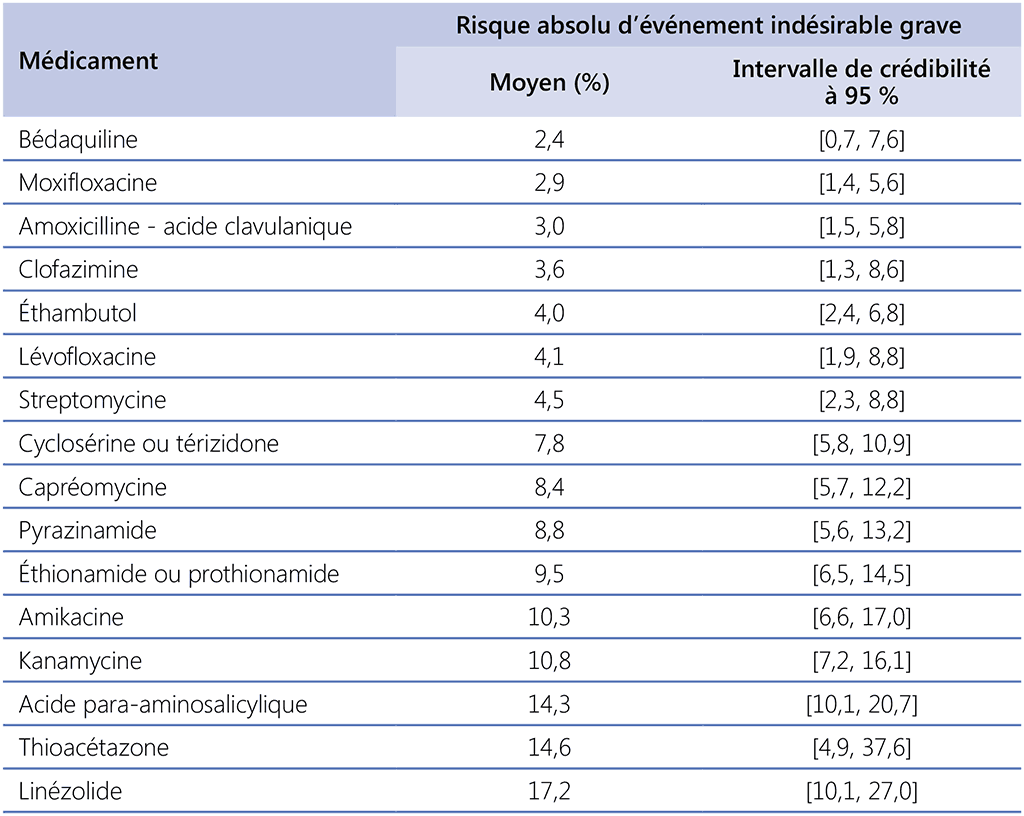
Étant donné que les interactions médicamenteuses, la charge médicamenteuse et la probabilité d’événements indésirables augmentent avec le nombre de produits dans un schéma, il serait souhaitable de donner aux patients le nombre minimum de médicaments nécessaires pour obtenir des niveaux comparables de guérison sans rechute. Pour décider du nombre minimum de médicaments à recommander, le GDG 2018 a examiné les analyses incluant des produits injectables dans les schémas, tout en sachant que les futurs schémas plus longs contiendraient de moins en moins d’injectables. En outre, il était important de prévoir des situations dans lesquelles plus d’un médicament est interrompu à un moment du traitement soit en raison de son indication – l’utilisation conforme au RCP de la bédaquiline et du délamanide est de 6 mois – soit en raison de la tolérabilité (en particulier le linézolide ; Tableau 3.3) (66); hce qui signifie que pendant presque toute sa durée, le schéma contiendrait deux médicaments clés de moins qu’au début. Bien que l’utilisation de la bédaquiline au-delà de 6 mois soit qualifiée de « hors RCP », de nouvelles données sur le profil d’innocuité de son utilisation au-delà de 6 mois ont été mises à la disposition du GDG en 2019. Les données corroborent l’utilisation sans risque de la bédaquiline au-delà de six mois chez les patients qui bénéficient de programmes de suivi appropriés. L’utilisation de la bédaquiline au-delà de 6 mois reste une utilisation hors RCP ; à cet égard, les meilleures pratiques en matière d’utilisation hors RCP s’appliquent toujours.
Les DIP 2018 comprenaient l’expérience de plus de 300 patients qui étaient traités avec du linézolide pendant au moins 1 mois, principalement à une dose de 600 mg/jour, avec des informations sur la durée de l’utilisation. Environ 30 % seulement avaient reçu du linézolide pendant 1 à 6 mois, mais plus de 30 % l’avaient reçu pendant plus de 18 mois et c’est chez ces deniers que la fréquence d’échec thérapeutique, de perdus de vue et de décès était la plus faible. Un graphique sur la durée du linézolide et l’échec thérapeutique laisse supposer que la durée d’utilisation optimale serait d’environ 20 mois, ce qui correspond à la durée totale habituelle d’un schéma plus long de la tuberculose MR. Toutefois, une telle analyse ne tient pas compte du biais de survie sélective, ce qui signifie que ceux qui prennent le traitement sur toute sa durée ont plus de chances d’avoir un résultat positif, étant donné que les décès et les cas perdus de vue surviennent plus tôt. Aucune tendance claire pour le type d’événement indésirable et la durée d’utilisation n’a pu être distinguée, bien que quelques cas aient été rapportés avec une neuropathie optique, connue pour être associée à l’utilisation à long terme du linézolide (67), tandis que la toxicité hématologique a été rapportée, quelle que soit la durée de l’utilisation.
Tableau 3.3. Événements indésirables graves chez les patients sous schémas plus longs de la tuberculose-MRᵃ
En 2018, le GDG recommandait que, dans la mesure du possible, les schémas soient composés des trois médicaments du groupe A et d’au moins un du groupe B, de sorte que le traitement commence avec au moins quatre médicaments susceptibles d’être efficaces et qu’au moins trois soient maintenus pendant la durée restante du traitement si la bédaquiline est arrêtée après 6 mois. De nouvelles données sur le profil d’innocuité de l’utilisation de la bédaquiline au-delà de 6 mois ont été communiquées au GDG 2019. Les données corroborent l’utilisation sans risque de la bédaquiline au-delà de six mois chez les patients qui bénéficient de programmes de suivi appropriés. Si seulement un ou deux médicaments du groupe A sont utilisés, les deux médicaments du groupe B doivent être inclus. Si le schéma ne peut pas être composé uniquement avec des produits des groupes A et B, ceux du groupe C sont ajoutés pour le compléter. Chez les patients pour lesquels il y a plus de risque que deux produits du groupe A soient arrêtés avant la fin du traitement (par exemple, des comorbidités préexistantes nécessitent un arrêt précoce de la bédaquiline et du linézolide en raison de risques pour la santé), il peut être conseillé de débuter avec cinq médicaments efficaces plutôt que quatre. Ces dispositions devraient s’appliquer à la plupart des patients atteints de tuberculose MR-RR, y compris ceux qui ont une résistance supplémentaire aux fluoroquinolones ou à d’autres médicaments.
Question PICO 8-2019 (tuberculose MR-RR, 2019) (utilisation de la bédaquiline pendant plus de six mois)
En ce qui concerne la question PICO 8–2019 (tuberculose MR-RR, 2019), l’analyse a donné des ORa de 1,5 (IC à 95 % : 0,7–2,7) pour le succès thérapeutique par rapport à l’échec, 0,8 (IC 95 % 0,2-0,4) pour le succès thérapeutique par rapport au décès, 1,0 (IC 95 % 0,5-1,7) pour le succès thérapeutique par rapport à l’échec ou au décès et 0,8 (IC 95 % 0,5-1,2) pour le succès thérapeutique par rapport à toutes les issues défavorables. Les examinateurs des données avaient prévu d’utiliser deux approches analytiques conçues pour minimiser les biais ; c’est-à-dire des modèles structurels marginaux pour tenir compte des facteurs de confusion variables dans le temps et l’appariement exact et sur score de propension des caractéristiques des patients. Toutefois, en raison de la taille de l’échantillon, il existait des limites dans la façon dont la première approche pouvait être appliquée ; De plus, les biostatisticiens ont indiqué qu’il n’était pas possible d’ajuster les facteurs de confusion en fonction du plan d’analyse des données original, du fait des limites avec l’ensemble de données. Le GDG 2019 a fait observer que la population incluse dans les études évaluées était rigoureusement sélectionnée, avec un risque de confusion par indication (c.-à-d. que les personnes ayant reçu la bédaquiline pendant plus de six mois l’avaient probablement fait en raison de facteurs cliniques indiquant un traitement prolongé avec la bédaquiline). Le GDG a conclu qu’il y avait une forte probabilité de confusion résiduelle dans les données et que la population de patients examinée dans l’étude ne permettait pas d’extrapoler l’utilisation systématique chez tous les patients atteints de tuberculose MR-RR. Cela empêchait de formuler une recommandation formelle sur l’efficacité de l’utilisation de la bédaquiline au-delà de six mois ; cependant le GDG a conclu qu’il était possible de faire une déclaration sur la sécurité. Ces informations figurent dans la Section 3.5 et dans une note du Tableau 3.1.
En ce qui concerne les événements indésirables, sur les 750 patients recevant de la bédaquiline sans délamanide dans l’étude d’observation endTB (exposition totale de 6 316 mois-personnes), 26 patients ont été victimes d’un événement indésirable lié aux médicaments (taux : 0,44 pour 100 mois-personne d’exposition), classé comme événement indésirable grave pour 16 d’entre eux (taux : 0,25 pour 100 mois-personnes d’exposition). Au cours des 203 premiers jours d’exposition à la bédaquiline (exposition totale de 4 304 mois-personnes), 20 événements indésirables liés aux médicaments sur 26 et 15 événements indésirables graves sur 16 ont eu lieu ; six autres événements indésirables liés aux médicaments sur 26 et un événement indésirable grave sur 16 sont survenus plus tard. Parmi les patients qui ont reçu de la bédaquiline pendant plus de 203 jours, aucun n’a subi d’événement indésirable lié aux médicaments (de quelque grade que ce soit) dans les 203 premiers jours de traitement. De plus, les taux d’événements indésirables liés aux médicaments se sont avérés plus faibles après les 203 premiers jours – 0,51 dans les 203 premiers jours contre 0,30 dans les jours suivants pour 100 mois-personnes. De même, les taux d’événements indésirables graves liés au médicament se sont avérés plus faibles après les 203 premiers jours – 0,35 au cours des 203 premiers jours contre 0,05 dans les jours suivants pour 100 personnes-mois.
Les valeurs de l’intervalle QTcF chez les personnes recevant de la bédaquiline ont augmenté en moyenne de 22 ms (de 397 ms à 419 ms) par rapport à celles prises avant ou au moment de la première dose de bédaquiline jusqu’à la fin du premier mois. Au cours des mois suivant l’exposition, les valeurs moyennes de l’intervalle QTcF étaient toutes inférieures à celles de la fin du premier mois (fourchette : 404 ms à 419 ms). Des augmentations de l’intervalle QTcF de plus de 60 ms par rapport à la valeur de départ étaient observées chez environ 12 % des patients. L’allongement de l’intervalle QTcF supérieur à 500 ms était rare, survenant chez 0,4 à 1,5 % des patients durant chaque des 9 premiers mois, mais aucun par la suite. Le plus grand nombre d’occurrences d’intervalle QTcF supérieur à 500 ms a été observé chez les personnes recevant la bédaquiline et la clofazimine ; cependant il s’agissait également de l’association de médicaments la plus courante.
Des effets indésirables cardiaques liés aux médicaments sont survenus chez 22 personnes ; quinze parmi les personnes recevant de la bédaquiline avec de la clofazimine, mais pas de moxifloxacine ou délamanide (taux : 0,3 pour 100 mois-personnes), cinq parmi les personnes recevant la bédaquiline avec la clofazimine et la moxifloxacine, mais pas de délamanide (taux : 0,3 pour 100 mois-personnes) et 2 parmi les personnes recevant la bédaquiline et le délamanide, indépendamment de l’utilisation de clofazimine et de moxifloxacine (taux : 0,2 pour 100 mois-personnes). Aucun événement ne s’est produit parmi les personnes recevant la bédaquiline sans clofazimine, moxifloxacine, et délamanide.
En ce qui concerne l’exposition à la bédaquiline pendant la grossesse, les résultats de l’étude de cohorte n’ont démontré aucune différence statistiquement significative dans l’issue de la grossesse ou de la naissance si l’on comparait les nourrissons exposés in utero à la bédaquiline à ceux qui ne l’avaient pas été (p=0,741 pour les issues de la naissance et p=0,312 pour les issues de la grossesse) (51). Il y a eu 45 naissances vivantes (92 % du total) dans le groupe exposé à la bédaquiline contre 54 naissances vivantes (90 % du total) dans le groupe non exposé. En outre, il y a eu quatre décès foetaux et néonatals chez les nourrissons exposés à la bédaquiline (8 % du groupe exposé à la bédaquiline, avec trois mortinaissances et une interruption de grossesse) et six décès foetaux et néonataux dans le groupe non exposé à la bédaquiline (10 % du groupe total non exposé, comprenant trois mortinaissances et trois fausses couches) (51). Les résultats de l’étude ont également démontré que les issues thérapeutiques étaient favorables pour les femmes enceintes exposées à la bédaquiline par rapport à celles non exposées (71 % contre 62 % respectivement, p=0,349) (51). Parmi les issues de la grossesse, on comptait des naissances vivantes et des issues défavorables (décès foetaux et néonatals, naissances prématurées à moins de 37 semaines et faible poids de naissance < 2500 g) ; les résultats des nourrissons comprenaient la prise de poids et les étapes du développement, ainsi que le diagnostic de tuberculose (51). Parmi tous les résultats évalués concernant la grossesse et les nourrissons, seul le faible poids de naissance était associé à l’exposition à la bédaquiline in utero (45 % contre 26 %, p=0,034). Le poids moyen chez les nourrissons exposés à la bédaquiline était de 2 690 g contre 2 900 g chez les nourrissons non exposés à la bédaquiline. Cependant, il n’a pas été possible d’attribuer de façon certaine cet effet à la bédaquiline et des investigations plus approfondies sont nécessaires pour étudier cette relation (51). Il n’y avait pas de différence significative dans la croissance des nourrissons après la naissance : dans une sous-analyse de 86 bébés suivis prospectivement – 41 exposés à la bédaquiline in utero et 45 non exposés – 88 % des bébés exposés à la bédaquiline in utero avaient une prise de poids normale à un an contre 82 % des bébés non exposés (p=0,914) (51).
Question PICO 9-2019 (tuberculose MR-RR, 2019) (utilisation concomitante de la bédaquiline et du délamanide).
En ce qui concerne la question PICO 9 (tuberculose MR-RR, 2019), les analyses ont donné des odds ratios ajustés de 1,6 (IC à 95 % 0,5-5,4) pour le succès thérapeutique par rapport à l’échec, 0,8 (IC 95 % 0,3-2,1) pour le succès thérapeutique par rapport au décès, 1,2 (IC à 95 % 0,6-2,5) pour le succès thérapeutique par rapport à l’échec ou au décès et 0,6 (IC à 95 % 0,3-1,1) pour le succès thérapeutique par rapport à toutes les issues défavorables. En ce qui concerne les événements indésirables, parmi les 92 patients recevant simultanément la bédaquiline et le délamanide pendant le traitement dans l’étude d’observation endTB (exposition totale de 1 095 mois-personnes), deux événements indésirables liés à la bédaquiline et au délamanide se sont produits (taux combiné : 0,46 pour 100 mois-personnes d’exposition). Ce taux était comparable aux taux des personnes recevant de la bédaquiline seule (0,41 pour 100 mois-personnes d’exposition) et du délamanide seul (0,68 pour 100 mois-personnes d’exposition). Deux événements indésirables graves liés aux médicaments ont eu lieu parmi les 92 patients recevant simultanément la bédaquiline et le délamanide, un attribué à chaque médicament (taux combiné : 0,09 pour 100 mois-personnes d’exposition). Le taux de ces événements était inférieur aux taux d’événements indésirables graves liés aux médicaments chez les patients recevant l’un ou l’autre médicament seul (bédaquiline, 0,28 ; délamanide, 0,39). Aucun événement mortel lié aux médicaments n’a eu lieu parmi les patients recevant simultanément la bédaquiline et le délamanide.
Les valeurs de l’intervalle QTcF chez les personnes recevant de la bédaquiline et du délamanide ont augmenté en moyenne de 15 ms (de 398 ms à 413 ms) par rapport à celles prises avant ou au moment de la première dose concomitante de bédaquiline et de délamanide, jusqu’à la fin du premier mois. Au cours des mois suivant l’exposition, les valeurs moyennes de l’intervalle QTcF étaient similaires à celles de la fin du premier mois (fourchette : 404 ms à 420 ms).
L’allongement de l’intervalle QTcF de plus de 500 ms était rare, observé chez un seul patient dans le mois 7 de l’exposition concomitante. Les effets indésirables cardiaques liés aux médicaments étaient rares, se produisant chez 2 des 92 personnes exposées simultanément à la bédaquiline et au délamanide (taux : 0,2 pour 100 mois-personnes). Un seul événement indésirable cardiaque grave, lié aux médicaments, est survenu (taux : 0,1 pour 100 mois-personnes). Aucun événement indésirable cardiaque lié aux médicaments mortels n’a eu lieu parmi les 92 patients exposés simultanément à la bédaquiline et au délamanide.
Dans l’étude d’observation, au total (n=1 094), il y a eu deux événements cardiaques mortels liés aux médicaments (décès brutaux attribuables à l’allongement de l’intervalle QT) et un patient a souffert d’arythmie cardiaque. Les deux décès se sont produits chez des patients recevant la bédaquiline, la clofazimine, la capréomycine et l’acide p-aminosalicylique (mais pas la moxifloxacine ou le délamanide) ; chez les deux patients, une hypokaliémie était présente. Ces patients n’ont pas été inclus dans l’analyse liée à cette question PICO, car ils ne répondaient pas aux critères d’inclusion selon le plan d’analyse statistique prédéfini. Toutefois, reconnaissant que ces estimations d’événements indésirables graves étaient absolues et non relatives, le groupe a estimé qu’il était important de surveiller de près ces données supplémentaires à l’avenir, lorsque les données finales de l’étude d’observation endTB seraient disponibles.
Le GDG a convenu qu’il n’y avait pas suffisamment de données pour évaluer l’efficacité de l’utilisation concomitante de la bédaquiline et du délamanide avec seulement 84 patients dans le groupe d’intervention et que les données ne se prêtaient pas à une analyse significative pour le comparateur secondaire (utilisation prolongée du délamanide seul), car les populations étaient trop différentes pour permettre l’appariement généralement effectué. Cela empêchait de formuler une recommandation formelle sur l’efficacité de l’utilisation concomitante de la bédaquiline et du délamanide ; cependant le GDG a conclu qu’il était possible de faire une déclaration sur la sécurité. Ces informations figurent dans la Section 3.5 et dans une note du Tableaux 3.1.
D’autres données présentées dans l’essai (DELIBERATE) mettaient en évidence le fait que chez les patients randomisés dans le groupe bédaquiline (n=28), délamanide (n=27) ou les deux médicaments (n=27), la modification sous traitement de l’intervalle QTcF par rapport au départ était respectivement de 11,9 ms, 8,6 ms et 20,7 ms.34 Sur les 27 patients ayant reçu les deux médicaments, 10 (37,0 %) ont subi un événement indésirable d’allongement de l’intervalle QT de grade 135 et deux (7,4 %) un événement d’allongement de l’intervalle QT de grade 2. Dans le bras de la bédaquiline, 32 % et 3,6 % des patients ont subi des événements indésirables liés à l’intervalle QT de grade 1 et 2 ; dans le bras délamanide, ces chiffres étaient de 41 % pour un événement indésirable QT de grade 1 et de 7,4 % pour un événement indésirable QT de grade 2. Aucun patient n’a connu d’événement indésirable lié à l’intervalle QT de grade 3 ou 4. Les investigateurs de l’étude ont conclu que les effets d’allongement de l’intervalle QTcF de l’utilisation concomitante de délamanide et de bédaquiline n’étaient pas plus nombreux que leurs effets additifs. Le GDG a souligné que les effets indésirables liés à l’intervalle QT dans l’essai DELIBERATE étaient des marqueurs de substitution de la mort subite cardiaque. Il a également noté que la lévofloxacine était la fluoroquinolone de choix dans les schémas donnés aux patients dans l’essai DELIBERATE et que le potassium sérique était étroitement surveillé.
Question PICO 1–2021 (tuberculose chez les enfants 2021) (utilisation de la bédaquiline chez les patients âgés de moins de 6 ans atteints de tuberculose MR-RR) et question PICO 2–2021 (tuberculose chez les enfants 2021) (utilisation du délamanide chez les patients âgés de moins de 3 ans atteints de tuberculose MR-RR)
En ce qui concerne la question PICO 1-2021 (tuberculose chez les enfants 2021) et la question PICO 2-2021 (tuberculose chez les enfants 2021), les détails de l’examen des données et des délibérations du GDG se trouvent dans le Module 5 : prise en charge de la tuberculose chez les enfants et les adolescents.
34 Personal communication, K Dooley, Johns Hopkins Medicine, November 2019 – pour cette déclaration et le reste de ce paragraphe.
35 Dans l’essai DELIBERATE, un événement indésirable lié à l’intervalle QT de grade 1 était classé comme un intervalle QTcF absolu dans les situations suivantes : >480 et ≤500 ms et un changement de l’intervalle QTcF par rapport au départ entre >0 ms et ≤30 ms OU un QTcF absolu ≤480 ms et un changement de QTcF par rapport au départ entre >30 ms et ≤60 ms. Un événement indésirable lié à l’intervalle QT de grade 2 était classé comme un intervalle QTcF absolu dans les situations suivantes : >480 et ≤500 ms et un changement de l’intervalle QTcF par rapport au départ entre >30 ms et ≤60 ms OU un QTcF absolu ≤480 ms et un changement de QTcF par rapport au départ >60 ms. Un événement indésirable lié à l’intervalle QT de grade 3 était classé comme un QTcF absolu dans la situation suivante : >500 ms OU un QTcF >480 et un changement de QTcF par rapport au départ >60 ms. Un événement indésirable lié à l’intervalle QT de grade 4 était une conséquence potentiellement mortelle ; par exemple la torsade des pointes ou autre dysrythmie ventriculaire grave associée (personal communication, K Dooley, Johns Hopkins Medicine, novembre 2019).
 Retour
Retour