Liens transversaux de livre pour 6. Safety and management of adverse drug reactions in TB preventive treatment

Cela fait longtemps que l’OMS recommande un TPT pour les populations exposées au risque de tuberculose, en particulier les personnes vivant avec le VIH et les enfants qui sont des contacts domestiques de patients tuberculeux. Mais le déploiement des TPT par les programmes est resté limité dans la plupart des pays supportant une lourde charge de tuberculose et d’infection à VIH, d’autres initiatives concurrentes ayant été jugées prioritaires. Les préoccupations concernant l’efficacité et l’innocuité des TPT et les interactions avec d’autres médicaments, notamment les ARV, peuvent aussi faire obstacle au déploiement des TPT par les programmes. D’autres questions sont soulevées fréquemment, à savoir la capacité d’un TPT à favoriser la pharmacorésistance dans la communauté et la pérennité de la protection qu’il assure contre la maladie et la mortalité. Le présent chapitre traite des données probantes disponibles sur certains de ces problèmes importants pour faciliter le recours à un TPT et son déploiement par les programmes.
Innocuité des médicaments et réactions indésirables aux traitements
En général, il est rare que la survenue de manifestations indésirables graves conduise au décès ou imposent l’arrêt du TPT. Toutefois, il est essentiel d’identifier le plus tôt possible tout signe de toxicité des médicaments et d’assurer sa prise en charge rigoureusement, en particulier lorsqu’il s’agit de personnes généralement en bonne santé. Mise à part leurs effets nocifs pour les personnes, de telles éventualités peuvent aussi être préjudiciables à la réputation du programme et entraîner la suspension à grande échelle d’autres TPT en raison de la perte de confiance du public. Comme pour toute mesure de prévention, le prestataire de soins de santé doit peser pour chaque patient les risques et les bienfaits du TPT. L’obtention d’antécédents médicaux détaillés et précis (y compris des médicaments pris et des réactions indésirables connues aux traitements) et la tenue à jour des informations à chaque entrevue avec le patient sur le TPT, peuvent aider à identifier les personnes nécessitant une surveillance étroite et à décider de la ligne de conduite la mieux adaptée lorsqu’émerge une manifestation indésirable. Les bénéficiaires d’un TPT doivent aussi être surveillés régulièrement au travers de visites programmées (si possible tous les mois ou selon les besoins, pour des soins individuels ou des programmes nationaux).
Le Tableau 6.1 résume les manifestations indésirables connues associées aux médicaments composant le TPT. Dans les conseils qu’il dispense initialement, l’agent de santé doit expliquer la raison d’être du TPT, l’importance du bon achèvement du traitement et insister à nouveau sur le risque de tuberculosemaladie. La personne bénéficiaire du TPT doit aussi être informée sur les manifestations indésirables possibles et priée instamment de contacter le prestataire de soins de santé si elle constate des manifestations évocatrices de toxicité des médicaments entre les visites (comme une perte d’appétit, une fatigue persistante ou une faiblesse, une gêne abdominale, des nausées, des vomissements, des urines foncées, des selles décolorées, une éruption cutanée ou des démangeaisons, le jaunissement de la peau ou des yeux, des fourmillements ou un engourdissement des mains ou des pieds). S’il n’est pas possible de consulter un agent de sons de santé lorsque surviennent ces symptômes, la personne sous TPT doit immédiatement interrompre le traitement. Les personnes traitées par rifamycine doivent être averties à l’avance de la décoloration rose des sécrétions due à ce médicament.
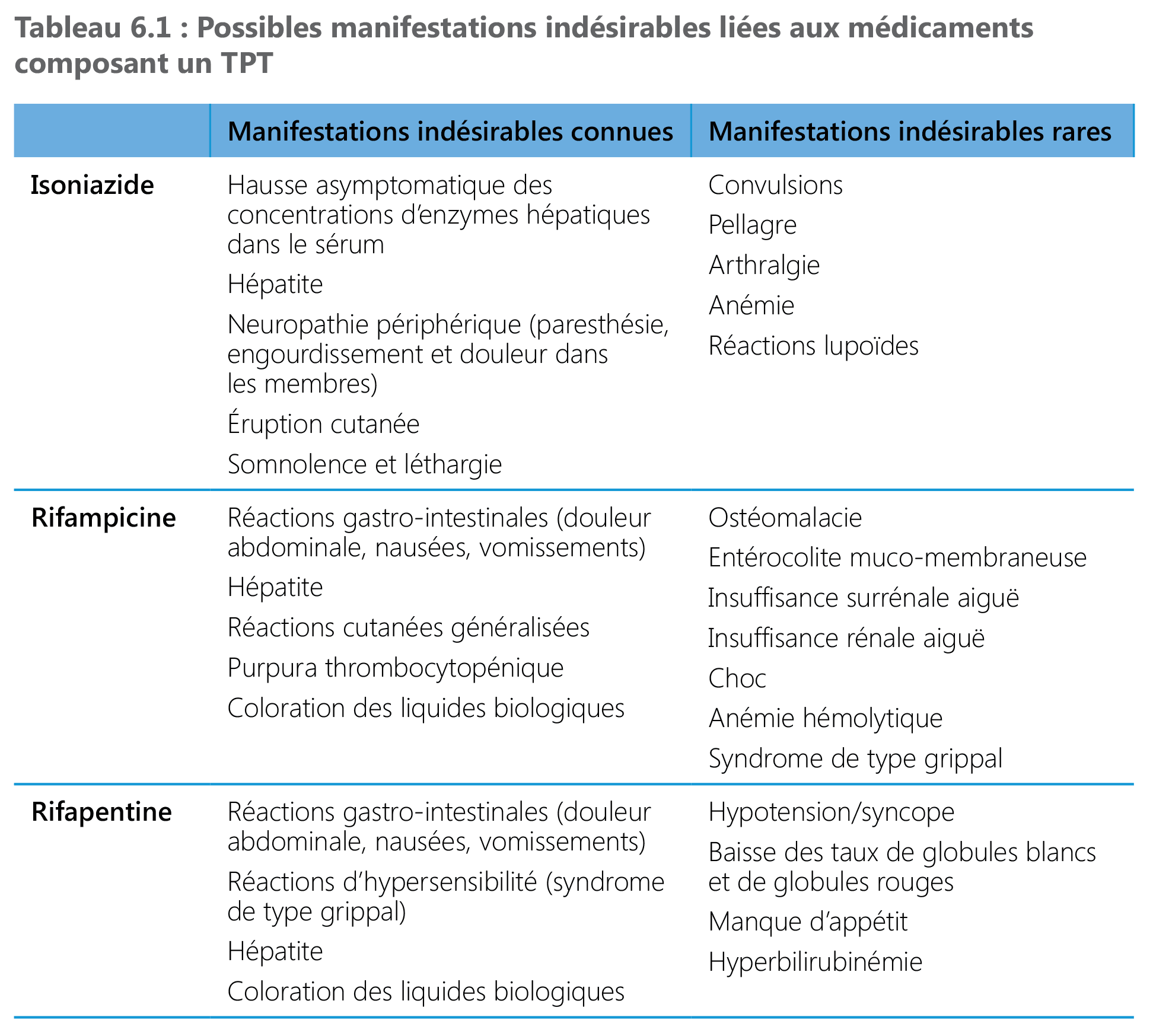
Les paragraphes qui suivent traitent de certaines des manifestations indésirables associées aux médicaments constitutifs d’un traitement préventif et de leur prise en charge.
Isoniazide
- La hausse asymptomatique des concentrations d’enzymes hépatiques dans le sérum survient chez 10 à 20 % des personnes traitées par isoniazide qui retrouvent généralement des niveaux normaux même si le traitement est poursuivi. Cependant, on recommande généralement le maintien de la prise d’isoniazide si les niveaux de transaminases sont trois fois supérieurs à la limite supérieure d’un taux normal, avec l’apparition de symptômes ou s’ils sont cinq fois supérieurs à la limite supérieure d’un taux normal en l’absence de symptômes.
- Des formes cliniques de l’hépatite conduisant au décès surviennent chez environ 0,1 % des personnes prenant de l’isoniazide et elles sont plus fréquentes si l’isoniazide est associée à d’autres agents hépatotoxiques. Les facteurs susceptibles d’augmenter le taux ou la gravité d’une hépatite sont notamment la consommation quotidienne d’alcool, une maladie du foie sous-jacente, un risque de maladie du foie, un âge supérieur à 65 ans et la prise concomitante d’autres médicaments métabolisés dans le foie. Les cas symptomatiques d’hépatite sont rares chez les moins de 20 ans bien que des cas graves voire mortels aient été signalés. Des jeunes exposés à des facteurs de risque sous-jacents de maladie du foie doivent bénéficier d’une surveillance clinique aussi attentivement que lorsqu’il s’agit de personnes âgées.
- La neuropathie périphérique (paresthésie, engourdissement et douleur dans les membres) survient chez moins de 0,2 % des personnes prenant des doses normales d’isoniazide. Elle est plus probable dans le cas d’autres pathologies associées à une neuropathie comme le diabète, la malnutrition, l’infection à VIH, l’insuffisance rénale et l’alcoolisme. Une supplémentation systématique de pyridoxine (vitamine B6) est recommandée uniquement lorsque ces pathologies sont présentes ou lorsqu’il y a un autre risque de toxicité par l’isoniazide.
- L’isoniazide est reconnue comme étant une cause secondaire de pellagre. Elle interrompt la production de niacine (vitamine B3) dans les cellules chez les personnes présentant une carence nutritionnelle. La niacine assure une fonction vitale dans de nombreux processus métaboliques. La pellagre est diagnostiquée par l’examen clinique d’une éruption cutanée caractéristique. La diarrhée et des changements neuropsychiatriques en sont d’autres symptômes. Les populations exposées à un risque accru de pellagre sont notamment des personnes qui consomment des quantités excessives d’alcool et celles dont l’alimentation est essentiellement à base de maïs, sans complément vitaminique.
- Les autres effets secondaires connus de l’isoniazide sont l’éruption cutanée, la somnolence et la léthargie.
Rifampicine
- Il est rare que les symptômes gastro-intestinaux comme les nausées, l’anorexie et les douleurs abdominales soient suffisamment graves pour justifier l’interruption d’un traitement.
- Une hépatotoxicité, mise en évidence par une hyperbilirubinémie asymptomatique transitoire, peut survenir chez 0,6 % des personnes prenant de la rifampicine. Une hépatite est plus probable lorsque la rifampicine est associée à l’isoniazide.
- Des réactions cutanées, comme un prurit (avec ou sans éruption) peuvent survenir chez environ 6 % des personnes prenant de la rifampicine. En règle générale, elles se résolvent d’elles-mêmes et peuvent ne pas être révélatrices d’une hypersensibilité. La poursuite du traitement peut être possible.
- Le syndrome d’hypersensibilité aux rifamycines a été signalé par le passé par suite de la prise de rifampicine, caractérisée par des syndromes de type grippal. Lorsqu’il survient, ce syndrome se développe généralement au bout de quelques semaines après le début du traitement et, dans la plupart des cas, le traitement antituberculeux peut être toléré par la suite (96,97). Il est rare que des médicaments de la classe des rifamycines puissent être associés à des réactions d’hypersensibilité, notamment hypotension, néphrite ou thrombocytopénie qui se manifestent par des symptômes tels que fièvre, céphalées, vertiges/légers étourdissements, douleurs musculo-squelettiques, pétéchies et prurit.
- La coloration orangée des liquides biologiques est prévisible et sans danger mais les personnes auxquelles on a prescrit un médicament de la classe des rifamycines doivent être informées au préalable.
Rifapentine
- Globalement, la rifapentine est associée à un plus petit nombre de manifestations indésirables liées à un TPT et est mieux tolérée, même par des personnes souffrant de dysfonctionnement hépatique à des degrés divers (98).
- Des réactions à des traitements systémiques, importantes d’un point de vue clinique, de type grippal pour la plupart, sont signalées chez 3,5 % des personnes recevant le protocole thérapeutique 3HP, la plupart étant modérées et résolues dans les 24 heures (99). Toutefois, une surveillance clinique et une vigilance ininterrompue des réactions aux médicaments systémiques sont assurées. Alors que certains rapports mentionnent chez certaines personnes une hypotension ou une syncope après la prise de médicaments du protocole 3HP, les épisodes d’hypersensibilité sont rares et se résolvent d’eux-mêmes rapidement après l’arrêt du traitement et sans aucun effet à long terme.
- Parmi d’autres effets secondaires courants citons le changement de couleur des liquides biologiques qui devient orange-rouge (bénin), les effets gastro-intestinaux (comme les nausées, les vomissements, le manque d’appétit), la diminution du nombre de globules blancs et de globules rouges, l’éruption cutanée ou les démangeaisons, les douleurs articulaires et les yeux rouges (100).
Une méta-analyse de réseau réalisée en 2014 (mise à jour en 2017) a comparé les manifestations indésirables associées au protocole standard à l’isoniazide avec les protocoles 3–4R et 3–4HR (45,101). Selon les conclusions, la rifampicine en monothérapie et la rifampicine en association avec l’isoniazide présentent moins de risque d’hépatotoxicité comparées à l’isoniazide en monothérapie. Un autre examen systématique des données de 23 études randomisées et de 55 études non randomisées en 2017 (102) ont fait apparaître des taux élevés d’hépatotoxicité avec les protocoles 6H/9H (2 à 6 %) et des taux plus bas avec les protocoles 3HP (1 %) et 3–4R (0,01 à 2 %) (Tableau 6.2). Cependant, cet examen a établi clairement l’insuffisance de la documentation globale sur les manifestations indésirables, l’hétérogénéité des données (différentes définitions de l’hépatotoxicité) et un risque élevé de biais dans les études. Les données ont malgré tout produit des indices sur la fréquence des manifestations indésirables et sur des événements qui finissent par aboutir à l’interruption d’un traitement préventif. Les taux médians les plus élevés d’interruption en raison de manifestations indésirables étaient associés au protocole 6H, suivi du protocole 9H et les taux les plus bas, au protocole 3HP. De possibles réactions d’hypersensibilité ont été signalées chez 4 % des personnes sous protocole 3HP et chez 2 % des personnes sous protocole 3HR. Les données sur des décès en cours de TPT, toutes causes confondues, sont moins fréquentes, mais dans les études incluses dans l’analyse, aucun décès n’a été notifié parmi les participants sous protocoles 9H, 3HP et 3–4R, alors que quelques décès sont survenus parmi les personnes sous protocoles 6H et 3–4HR pour la plupart selon les études menées auprès de personnes vivant avec le VIH mais non traitées par ARV ou atteintes d’autres comorbidités. Fait rassurant, une anaphylaxie a été rarement signalée, quel qu’ait été le protocole thérapeutique utilisé.
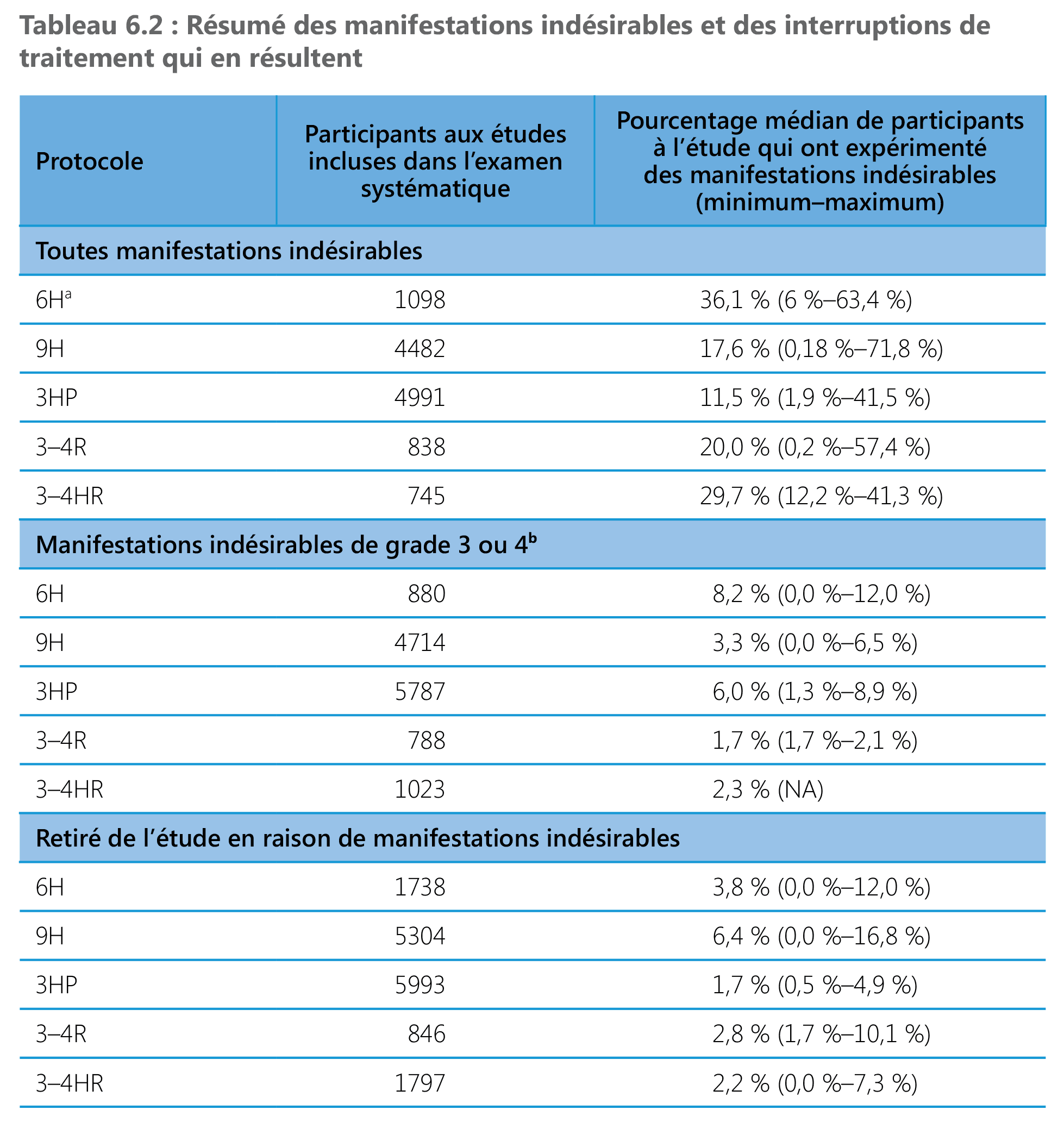
Une étude qui a comparé la capacité à être bien toléré du protocole 3HP et celle du protocole 9H parmi des sujets positifs ou négatifs pour le VIH a constaté des taux supérieurs de toxicité et d’hépatotoxicité de grades 3 et 4 et de graves manifestations indésirables chez les personnes VIH-positives traitées par le protocole 9H. Cependant, les personnes vivant avec le VIH ont expérimenté moins de réactions de type grippal ou d’hypersensibilité médicamenteuses systémiques (1,0 % contre 4,6 %; P = 0,01) comparé aux personnes VIH-négatives (53).
 Retour
Retour