Liens transversaux de livre pour Annex 6. Variables to be collected for TB contact evaluation
Que sont les tests IGRA ?
Les tests de libération de l’interféron gamma (IGRA) sont des tests réalisés sur sang total pour aider au diagnostic de l’infection à M. tuberculosis (43). Comme le TCT, les tests IGRA ne peuvent pas différencier l’infection tuberculeuse de la tuberculose-maladie. L’OMS a examiné en 2017 les données probantes disponibles concernant les deux tests IGRA les plus couramment utilisés, le test QuantiFERON®-TB Gold In-Tube (QFT-GIT) et le test T-SPOT.TB® (T-Spot), pour faciliter la recommandation sur leur utilisation en vue d’identifier les personnes porteuses d’une infection tuberculeuse.
Comment fonctionnent les tests IGRA ?
Chez les personnes infectées par M. tuberculosis, les leucocytes libèrent les interférons gamma (IFN-g) lorsqu’ils se trouvent activés au contact des antigènes dérivés de M. tuberculosis. Le fait de reconnaître le rôle clé de l’interféron gamma dans les réponses immunitaires à médiation cellulaire à l’infection par M. tuberculosis a conduit à la mise au point des tests IGRA (149–151). Les tests IGRA détectent la sensibilité à M. tuberculosis en mesurant la quantité d’interférons gamma libérés au contact des antigènes de M. tuberculosis. Les tests IGRA évaluent la réponse à des peptides chevauchants synthétiques représentant les protéines spécifiques du complexe M. tuberculosis, comme ESAT-6 (early secretory antigenic target-6) et CFP-10 (culture filtrate protein 10). Ces protéines sont présentes dans toutes les espèces du complexe M. tuberculosis et stimulent la libération mesurable de l’interféron gamma chez la plupart des personnes infectées mais elles sont absentes des souches vaccinales du BCG et de la plupart des mycobactéries non tuberculeuses. Pour que les tests IGRA mesurent avec précision la quantité d’interférons gamma libérés, il faut prélever un échantillon de sang frais contenant des leucocytes viables.
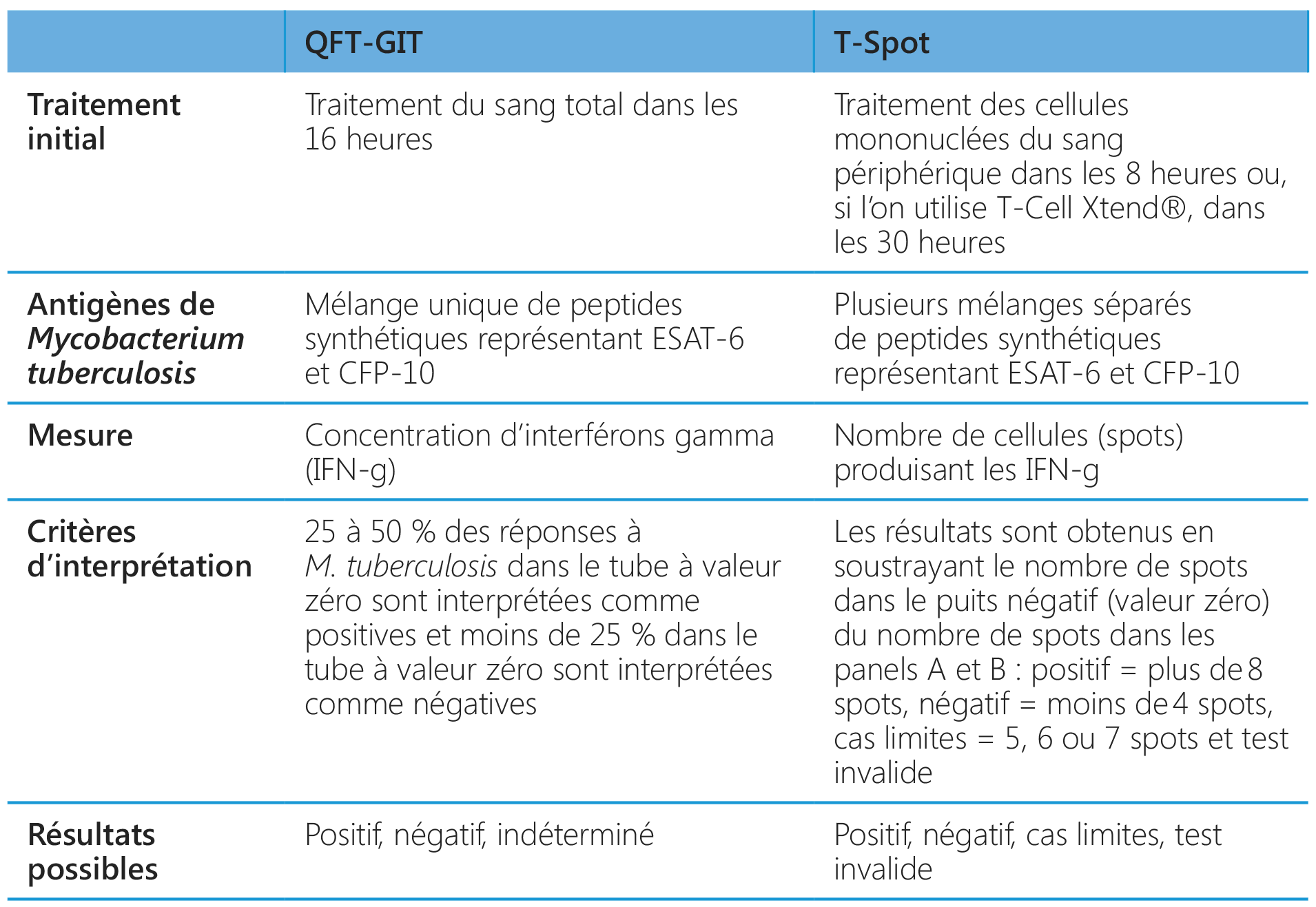
Le test QFT-GIT¹³: Dans ce test, le matériel et les antigènes sont contenus dans des tubes spéciaux destinés à recueillir le sang nécessaire au test, permettant ainsi une mesure plus directe du sang frais. L’un des tubes contient l’héparine et les antigènes peptidiques (simple mélange de 14 peptides représentant les séquences complètes en acides aminés des protéines ESAT-6 et CFP-10 et une partie de la séquence de TB7.7). Deux autres tubes servent pour les contrôles négatif et positif. Le tube de contrôle négatif contient uniquement de l’héparine et le tube de contrôle positif contient héparine, dextrose et phyto-hémagglutinine. Le sang (1 ml) est recueilli dans chacun des trois tubes, déjà mélangé aux réactifs dans les tubes et incubé pendant 16 à 24 heures. Puis le plasma est prélevé et la concentration d’interférons gamma dans le plasma est déterminée par test ELISA. Pour interpréter le test QFT-GIT, la réponse est calculée par une soustraction, à savoir la concentration d’interférons gamma dans le plasma issu du sang contenant des antigènes (c’est-à-dire le cocktail de peptides représentant ESAT-6, CFP-10 et TB7.7) moins la concentration d’interférons gamma dans le plasma issu du sang incubé sans antigène (c’est-à-dire dans le tube de valeur zéro).
T-SPOT : Les cellules mononuclées du sang périphérique sont incubées avec des tubes contrôles et deux mélanges de peptides, l’un représentant les séquences de chevauchement de la séquence entière en acides aminés de ESAT-6 et l’autre représentant la séquence entière en acides aminés de CFP-10. Il identifie les cellules effectrices sensibles à M. tuberculosis, activées par la présence des antigènes peptidiques CFP 10 et ESAT-6. Les lymphocytes T effecteurs ont un cycle de vie court ; cependant, leur présence continue indique par la réponse immunitaire que le sujet se trouve en contact avec un agent pathogène quelque part dans l’organisme et lutte contre cet agent. Mesurer la présence des lymphocytes T effecteurs dans un échantillon de sang révèle donc la présence d’une infection tuberculeuse. L‘échantillon de sang est centrifugé puis dilué pour faire en sorte qu’un même nombre de cellules mononuclées du sang périphérique soit ajouté dans chacun des quatre puits de microtitration (un contrôle négatif, un panel d’antigènes ESAT-6 (panel A), un panel d’antigènes CFP 10 (panel B) et un contrôle positif), préenduits d’anticorps anti-IFN-g et incubés pendant 16 à 20 heures. En présence de lymphocytes T effecteurs activés (personnes infectées), les antigènes spécifiques de M. tuberculosis, ESAT-6 et CFP 10 stimulent la libération d’interférons gamma (IFNg), ce qui provoque l’agglomération des anticorps à IFN-g au fond du puits. Les puits sont lavés et un anticorps secondaire à IFN-g est ajouté. À la suite d’une autre étape d’incubation et de lavage, le substrat soluble est ajouté. Il se forme alors des spots de précipité insoluble au fonds des puits, où les interférons gamma ont été sécrétés par les lymphocytes T. Le comptage des spots dans chaque puits donne le résultat du test et l’on compare la différence entre chaque panel d’antigènes et le contrôle négatif. La lecture du résultat est faite manuellement ou par un lecteur ELISPOT ;
Tests IGRA disponibles actuellement
Quels sont les avantages des tests IGRA ?
• Une seule visite nécessaire pour réaliser le test. Mais les résultats peuvent n’être disponibles qu’au bout de 24 heures, ce qui nécessite une deuxième visite.
• Une vaccination antérieure par le BCG ne donne pas de résultats faussement positifs aux tests IGRA.
• Pour le dépistage en série ou périodique sur des personnes pouvant se trouver, par leur profession, exposées à la tuberculose (comme les agents de santé travaillant dans les programmes de surveillance), les tests IGRA présentent des avantages techniques, logistiques et éventuellement économiques comparé aux tests cutanés à la tuberculine (TCT). Un test en deux temps n’est pas nécessaire pour les tests IGRA puisque ces tests n’amplifient pas les résultats de tests ultérieurs.
• La American Academy of Paediatrics a révisé ses lignes directrices pour élargir les tests IGRA aux enfants âgés de deux ans, ce qui implique que les tests IGRA peuvent désormais être réalisés sur des enfants âgés de deux ans et plus (152).
Quels sont les inconvénients et les limites des tests IGRA ?
• Les échantillons de sang doivent être traités dans les 8 à 30 heures après leur prélèvement, délai pendant lequel les leucocytes sont encore viables.
• Des erreurs dans le prélèvement ou le transport des échantillons de sang ou dans le déroulement du test peuvent diminuer la précision des résultats.
• Le coût de ces tests est élevé.
• Un plus grand risque de conversion des tests IGRA du fait de résultats faussement positifs nécessite de soumettre à un test de suivi des agents de santé à faible risque dont les tests ont donné un résultat négatif à un dépistage précédent. On parle de conversion lorsqu’un test IGRA ayant donné un résultat négatif devient positif dans les deux années qui suivent. Aucune association n’a pu être démontrée entre la conversion d’un test IGRA et un risque ultérieur de maladie.
• Les données sur l’utilisation des tests IGRA sont insuffisantes pour prédire qui développera une tuberculose-maladie dans le futur.
• Données insuffisantes sur l’utilisation des tests IGRA chez des enfants de moins de deux ans (plus grand risque de résultats indéterminés), chez des personnes exposées récemment à M. tuberculosis ou des personnes immunodéprimées, et dans des tests en série.
Quelles sont les étapes de la réalisation d’un test IGRA ?
• Les tests IGRA doivent être réalisés et interprétés conformément aux protocoles établis.
• Les dispositions prises pour des tests IGRA doivent être définies avant les prélèvements de sang pour s’assurer que ces échantillons soient recueillis dans les bons tubes.
• Prélever un échantillon de sang sur la personne en se conformant aux instructions du fabricant du test.
• Les tests IGRA doivent être réalisés et interprétés conformément au protocole national en place.
• Organiser la livraison de l’échantillon de sang au laboratoire dans le délai spécifié par le laboratoire pour s’assurer qu’au moment du test, les leucocytes soient encore viables.
• Fixer un rendez-vous à la personne pour qu’elle vienne chercher les résultats de son test.
• En fonction des résultats d’un test, réaliser une évaluation de suivi et administrer un traitement si nécessaire.
Le personnel infirmier et d’autres agents de santé qui ont suivi une formation de phlébotomie peuvent demander un test IGRA et transmettre le résultat à la personne concernée en expliquant sa signification.
Comment interpréter les résultats d’un test IGRA ?
Les résultats des tests IGRA indiquent la quantité d’interférons gamma libérés ou le nombre de lymphocytes T qui libèrent les interférons gamma. L’interprétation qualitative standard du résultat d’un test (positif, négatif ou indéterminé) ainsi que les mesures de concentration des interférons gamma (valeur zéro, concentrations d’antigènes de M. tuberculosis et concentrations de mitogènes ou comptage de spots) doivent être notifiés. Cela permettra une évaluation plus fine et une meilleure compréhension des résultats des tests. Tout comme les tests cutanés à la tuberculine (TCT) les tests IGRA doivent être utilisés comme une aide au diagnostic d’une infection à M. tuberculosis. Le résultat positif d’un test évoque la probabilité d’une infection à M. tuberculosis et un résultat négatif signifie qu’une infection est peu probable. Un résultat indéterminé indique une probabilité incertaine d’infection à M. tuberculosis. Un résultat limite (test T-Spot seulement) indique aussi une probabilité incertaine d’infection à M. tuberculosis.
Pour les personnes en bonne santé qui ont une faible probabilité à la fois d’être porteuses d’une infection tuberculeuse et de développer une tuberculose-maladie, un seul résultat positif d’un test IGRA ou d’un TCT ne doit pas être considéré comme une preuve fiable d’infection à M. tuberculosis. Du fait de la faible probabilité d’une infection, il est plus probable qu’il s’agisse d’un résultat faussement positif. Dans de telles situations, la probabilité d’une infection à M. tuberculosis et d’une évolution vers une tuberculose-maladie doit être réévaluée et les résultats du test initial doivent être confirmés. La répétition d’un test, soit identique au test initial soit par une autre méthode, peut être envisagée au cas par cas ou, autrement, on peut supposer que le résultat initial est un faux-positif, sans procéder à un autre test.
¹³ Veuillez noter que les indications portent uniquement sur les tests IGRA recommandés actuellement dans les lignes directrices 2020 de l’OMS relatives à la gestion par les programmes des TPT qui s’appuient sur des examens réalisés en 2017. Les fabricants du QFT-GIT prévoient de retirer progressivement ce test pour le remplacer par le nouveau test QFT 4 tubes.
 Retour
Retour