Liens transversaux de livre pour Annex 4. Standard operating procedures for sample collection methods
Cette annexe fournit des exemples de modes opératoires normalisés pour les méthodes les plus courantes de prélèvement d’échantillons cliniques chez les enfants en vue de la réalisation de tests moléculaires rapides : expectorations, aspiration gastrique, aspiration nasopharyngée et induction d’expectorations.
Pratiques de biosécurité et de contrôle de l’infection à suivre lors des procédures induisant de la toux et lors des actes générant des aérosols
L’aspiration gastrique, l’aspiration nasopharyngée et l’induction d’expectorations sont considérées comme des actes générant des aérosols. Bien que les enfants atteints de tuberculose soient généralement moins susceptibles d’être contagieux que les adultes, une transmission par de jeunes enfants est possible.
Les mesures de biosécurité exposées ci-après doivent être prises lors de la réalisation de l’une de ces procédures chez des enfants qui ont des facteurs prédictifs de contagion (notamment ceux qui ont une atteinte pulmonaire ou une atteinte laryngée importante, par exemple une toux depuis plus de 3 semaines, ou une tuberculose avec des cavités) :
- Si l’enfant est considéré comme contagieux, ces procédures doivent être effectuées dans une salle réservée aux patients qui toussent, disposant d’un flux d’air directionnel et avec 6 à 12 renouvellements d’air par heure.
- Tous les membres du personnel concernés doivent utiliser un équipement de protection individuelle (masques de protection respiratoire filtrant les particules comme des masques N95 ou FFP2, des lunettes de protection, des gants et un tablier en plastique). Les personnes qui s’occupent de l’enfant et qui aident le personnel à effectuer la procédure (par exemple, en tenant l’enfant pendant le prélèvement de l’échantillon) doivent porter un masque de protection respiratoire filtrant les particules.
- Un panneau indiquant qu’un prélèvement d’échantillons est en cours à l’intérieur doit être installé à l’extérieur de la pièce afin d’éviter que quelqu’un ne pénètre dans celle-ci pendant la procédure.
- Les personnes impliquées doivent se laver les mains avant et après la procédure, en suivant le protocole local de lavage des mains. Toutes les surfaces doivent être nettoyées avec une solution d’alcool à 70 % avant et après chaque procédure.
- Après la collecte, les récipients dans lesquels se trouvent les échantillons doivent être fermés hermétiquement. La partie extérieure du récipient doit être désinfectée avant d’y noter des informations concernant l’échantillon. L’échantillon doit ensuite être placé dans un sac à échantillons.
- Après la procédure, les masques, les gants et les tabliers jetables doivent être jetés dans un sac en plastique ou une poubelle appropriée, et il convient de se désinfecter les mains immédiatement.
- Après le prélèvement de l’échantillon, un délai d’au moins 10 minutes doit être respecté avant d’ouvrir la porte pour laisser sortir quelqu’un. Celle-ci doit être refermée immédiatement. L’heure à laquelle la procédure suivante pourra être effectuée doit être clairement indiquée.
Expectorations30
Généralités
Tous les échantillons d’expectorations produits par les enfants et les adolescents doivent être envoyés au laboratoire pour la réalisation d’un TDMRO. Les enfants et les adolescents qui peuvent produire un échantillon d’expectorations peuvent transmettre la maladie. Il faut donc leur demander de produire cet échantillon à l’extérieur et non dans un espace clos (par exemple, dans une salle de bains), à moins qu’il n’existe une pièce spécialement équipée pour la collecte des expectorations.
Procédure
- Rassurer l’enfant ou l’adolescent en lui expliquant, ainsi qu’à sa famille, la raison du prélèvement d’expectorations et la procédure à suivre.
- Demander à l’enfant ou à l’adolescent de se rincer la bouche avec de l’eau avant de produire l’échantillon, ce qui aidera à retirer les aliments ainsi que les bactéries contaminantes qui pourraient se trouver dans la bouche.
- Demander à l’enfant ou à l’adolescent de respirer deux fois profondément, en retenant sa respiration pendant quelques secondes après chaque inspiration, puis en expirant lentement. Lui demander ensuite d’inspirer une troisième fois, puis d’expirer l’air avec force. Lui demander de respirer à nouveau, puis de tousser. Cela doit permettre de faire sortir des expectorations provenant de
la partie profonde des poumons. Demander à l’enfant ou à l’adolescent de tenir le contenant à expectorations près de ses lèvres et de cracher avec précaution dedans après une toux productive. - Si la quantité d’expectorations est insuffisante, encourager l’enfant ou l’adolescent à tousser à nouveau jusqu’à obtenir un échantillon adéquat. Produire des expectorations provenant de la partie profonde des voies respiratoires demande souvent un peu de temps. Laisser à l’enfant ou à l’adolescent le temps de produire des expectorations qui, selon lui, auront été obtenues à partir d’une toux profonde.
- Si aucune expectoration n’a été obtenue, considérer le crachoir comme usagé et l’éliminer comme il convient.
Aspiration gastrique31
Généralités
Les enfants atteints de tuberculose peuvent avaler du mucus contenant du bacille M. tuberculosis. L’aspiration gastrique est une technique utilisée pour collecter un échantillon du contenu gastrique afin d’essayer de confirmer le diagnostic de tuberculose à l’aide de tests moléculaires rapides (ou d’une culture de mycobactéries, si les tests rapides ne sont pas disponibles). Les échantillons de liquide d’aspiration gastrique sont utilisés pour la réalisation de tests diagnostiques chez les jeunes enfants lorsqu’il n’est pas possible d’obtenir des expectorations spontanées, ou des expectorations induites à l’aide d’une solution saline hypertonique. Cette méthode est particulièrement utile chez les
jeunes enfants hospitalisés. Un échantillon de liquide d’aspiration gastrique est collecté chez les jeunes enfants qui ont une tuberculose pulmonaire présumée. Pendant le sommeil, l’appareil mucociliaire du poumon fait remonter le mucus dans la gorge. Le mucus est avalé et reste dans l’estomac jusqu’à ce que celui-ci se vide. Les échantillons qui permettent d’obtenir les meilleurs résultats sont donc collectés tôt le matin.
Matériel nécessaire
- Gants non stériles ;
- Masques de protection respiratoire filtrant les particules (N95 ou équivalent) ;
- Tablier jetable ;
- Lunettes de protection ;
- Sondes nasogastriques (6 à 10 CH), de préférence de type Ryles ou Levin ;
- Seringues de 5, 10 et 20 ml ;
- Récipient stérile pour échantillons avec bouchon à vis (tube Falcon) ;
- Papier tournesol/bandelettes pour mesure du pH ;
- Solution de bicarbonate de sodium à 4 % pour la neutralisation sur place ;
- Trois draps de lit ou draps chirurgicaux (un pour le lit, un pour envelopper l’enfant, un pour le couvrir) ;
- Compte-gouttes ou seringue de petite taille ;
- Sérum physiologique (NaCl à 0,9 %) ou eau stérile en dosettes à usage unique ;
- Gel pour anesthésie locale ;
- Oxymétazoline (facultatif, pour la prévention des épistaxis) ;
- Alcool ou chlorhexidine ;
- Formulaire de demande d’examen de laboratoire ;
- Marqueur ou stylo indélébile ;
- Savon antiseptique
Contre-indications
- Enfant qui n’est pas à jeun depuis 4 heures ou plus (3 heures pour les nourrissons) ;
- Numération des plaquettes basse ou tendance aux saignements ;
- Lésions obstructives au niveau des voies nasopharyngées
Procédure
- Cette procédure est couramment réalisée par le personnel infirmier.
- Les parents de l’enfant ou la personne qui en a la charge doivent être informés de la nécessité d’être à jeun depuis au moins 4 heures avant d’effectuer l’aspiration gastrique tôt le matin. La procédure est réalisée de préférence tôt le matin. Elle peut également être réalisée au cours de la journée, à
condition que l’enfant soit à jeun depuis au moins 4 heures. - Se faire aider par un assistant (par exemple, par la personne qui s’occupe de l’enfant).
- Préparer tout le matériel nécessaire avant de commencer la procédure.
- Désinfecter toutes les surfaces de travail, y compris le lit. Placer un drap sur le lit. Utiliser un drap pour immobiliser l’enfant et un autre pour le couvrir, en laissant sa tête découverte.
- Positionner l’enfant sur le dos ou sur le côté avec l’aide de l’assistant.
- Facultatif : instiller 2 gouttes d’oxymétazoline dans chaque narine afin de provoquer une vasoconstriction et prévenir la survenue d’une épistaxis.
- Mesurer avec la sonde nasogastrique la distance entre le nez et l’estomac de l’enfant afin d’estimer sur quelle longueur la sonde devra être insérée pour atteindre l’estomac.
- Enduire l’extérieur de la sonde nasogastrique de gel pour anesthésie locale, sans recouvrir les orifices de la sonde.
- Positionner le visage de l’enfant le nez vers le haut comme s’il était en train de « renifler l’air », puis faire glisser la sonde nasogastrique par le nez jusqu’à l’estomac afin d’aspirer le contenu gastrique. Raccorder une seringue (de 10 ml en cas d’utilisation d’une sonde de Levin, ou de 20 ml en cas d’utilisation d’une sonde de Ryles) à la sonde nasogastrique (de taille 6 à 10 CH, en fonction de la taille de l’enfant).
- Retirer (aspirer) le contenu gastrique à l’aide de la seringue raccordée à la sonde nasogastrique.
- Pour vérifier que la position de la sonde est correcte, faire un test sur le contenu gastrique avec du papier tournesol : le papier tournesol de couleur bleu vire au rouge en présence de contenu gastrique acide. (Cette vérification peut également se faire en insufflant 3 à 5 ml d’air contenu dans une seringue dans l’estomac et en positionnant un stéthoscope sur l’estomac.)
- Aspirer avec précaution et de manière continue le contenu de l’estomac, en plaçant l’enfant dans chacune des trois positions suivantes : tête au centre, position latérale gauche et position latérale droite. Après chaque changement de position, attendre quelques secondes avant de procéder à l’aspiration. Si aucun liquide ne peut être aspiré, enfoncer ou retirer le tube de 1 à 2 cm, puis procéder à une nouvelle aspiration. Il est préférable de collecter un échantillon de 5 ml (en particulier lorsque l’enfant est malade), mais tout échantillon de plus de 1 ml est suffisant pour effectuer des tests bactériologiques.
- Si le volume aspiré est inférieur à 1 ml, il est possible de procéder à un lavage gastrique :
– Introduire 10 ml d’eau stérile ou de sérum physiologique sans conservateur dans la sonde nasogastrique, laisser en place pendant 3 minutes, puis procéder à une aspiration jusqu’à obtenir un minimum de 5 à 10 ml de liquide.
– S’il n’a pas été possible d’aspirer de liquide, introduire 10 ml supplémentaires d’eau stérile et procéder à une nouvelle aspiration. Si l’aspiration est toujours infructueuse, renouveler l’opération un maximum de trois fois. - Transférer la totalité du liquide gastrique contenu dans la seringue dans un récipient stérile (tube Falcon).
- Procéder à un titrage de bicarbonate de sodium à 4 % à l’aide d’une pipette ou d’une seringue et de bandelettes à pH, en ajoutant progressivement à l’échantillon des aliquots de 0,3 ml jusqu’à ce que le pH se situe entre 6 et 7. (Ce procédé permet de neutraliser l’acidité du contenu gastrique et empêche la destruction des bacilles tuberculeux). Après chaque ajout de bicarbonate, vérifier le pH à l’aide de papier tournesol.
Après la procédure
- Nettoyer le tube Falcon avec des compresses alcoolisées.
- Noter les informations suivantes sur l’échantillon : type et numéro de l’échantillon, date, heure, heure de la neutralisation, volume de bicarbonate ajouté et volume total de l’échantillon.
- Remplir le formulaire de demande d’examen de laboratoire.
- Acheminer l’échantillon dans une glacière jusqu’au laboratoire pour qu’il soit traité le plus rapidement possible (dans les 4 heures).
- Si le transport risque de ne pas pouvoir se faire dans les 4 heures, placer les échantillons au réfrigérateur (entre 4 et 8 °C) pour les conserver au frais jusqu’au transport.
- Alimenter l’enfant normalement.
Aspiration nasopharyngée32
Matériel nécessaire
- Gants non stériles ;
- Masques de protection respiratoire filtrant les particules (N95 ou équivalent) ;
- Tablier jetable ;
- Lunettes de protection ;
- Machine d’aspiration (aspirateur) ;
- Sonde nasogastrique (6 à 10 CH) et extracteur de mucus (6 à 8 G) stérile ;
- Sérum physiologique (NaCl à 0,9 %) ou eau stérile en dosettes à usage unique ;
- Un ou deux draps pour envelopper l’enfant ;
- Oxymétazoline (facultatif, pour la prévention des épistaxis) ;
- Coton ;
- Alcool ou chlorhexidine ;
- Récipient stérile pour échantillons avec bouchon à vis (tube Falcon) ;
- Formulaire de demande d’examen de laboratoire ;
- Marqueur ou stylo indélébile ;
- Savon antiseptique.
Contre-indications
- Enfant qui n’est pas à jeun depuis 2 heures ou plus ;
- Numération des plaquettes basse ou tendance aux saignements ;
- Lésions obstructives au niveau des voies nasopharyngées.
Procédure
- Expliquer de façon claire à l’enfant et à sa famille la raison de la collecte d’un échantillon de produit d’aspiration nasopharyngée ainsi que les principales étapes de la procédure.
- Placer l’enfant en position couchée sur le dos ou sur le côté, ou assis sur les genoux d’un membre de la famille ou de la personne qui s’occupe de lui.
- Pour éviter que les jeunes enfants ne se blessent en remuant, il est recommandé de les envelopper dans un drap ou équivalent et de demander à un assistant infirmier de tenir leur tête pendant
toute la durée de la procédure. - Nettoyer le nez de l’enfant avec des gouttes de solution saline et du coton. Si l’enfant est suffisamment âgé, lui demander de se moucher dans un mouchoir en papier. Si le mucus nasal est trop épais pour être éliminé en procédant comme indiqué, il peut être aspiré avant de procéder à l’aspiration nasopharyngée. Pour ce type d’aspiration, utiliser un cathéter souple (6/7 CH), puis le jeter immédiatement après la procédure.
- Raccorder la sonde à l’extracteur de mucus et l’extracteur de mucus à la pompe de l’aspirateur. Ne pas connecter la sonde seule directement à la machine d’aspiration.
- Une goutte d’oxymétazoline peut être instillée dans chaque narine pour prévenir la survenue d’une épistaxis.
- Instiller deux gouttes de solution saline stérile dans chaque narine.
- Mesurer la distance entre la narine et l’ouverture externe de l’oreille afin de déterminer la longueur de sonde à insérer pour aspirer l’échantillon de produit d’aspiration nasopharyngée.
- Choisir la taille de la sonde et adapter la pression en fonction de l’âge de l’enfant :
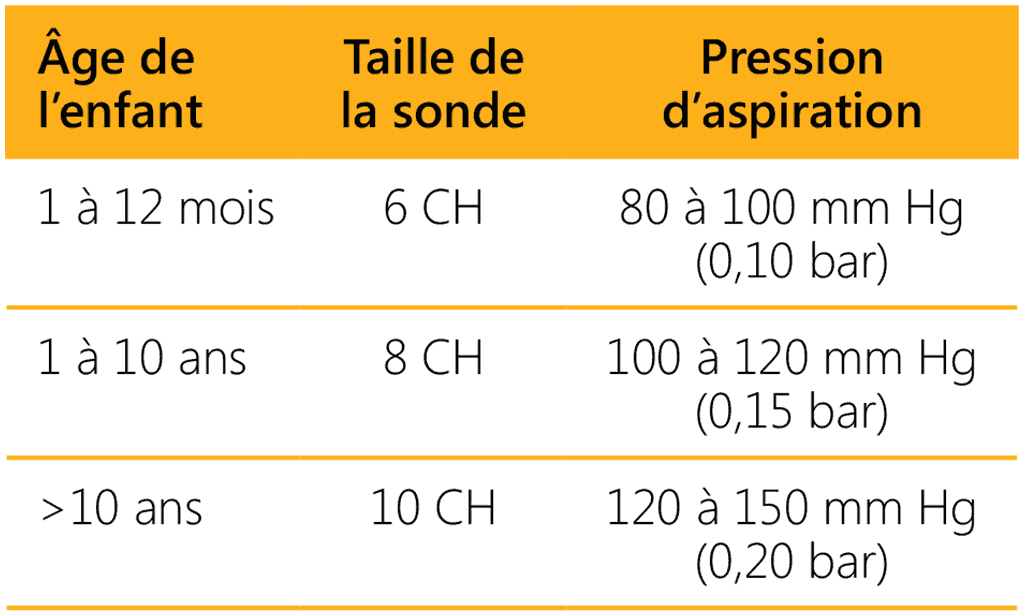
- Sans exercer d’aspiration, insérer la sonde en passant par l’une des narines de l’enfant, puis en suivant la paroi postérieure du pharynx jusqu’à atteindre la longueur mesurée. Si l’enfant n’a pas de dents, le tube peut être introduit par la bouche. Procéder avec précaution afin d’éviter de provoquer un traumatisme. Généralement, l’insertion de la sonde provoque une toux chez l’enfant et la production d’expectorations qui peuvent ensuite être aspirées.
- Attendre que l’extrémité de la sonde se trouve dans la partie postérieure du nasopharynx pour activer l’aspiration.
- En effectuant un mouvement de rotation, collecter les sécrétions respiratoires en retirant lentement la sonde. Ne pas enfoncer davantage le tube au moment de l’aspiration pour ne pas augmenter le risque de traumatisme local.
- La sonde doit rester le moins longtemps possible dans le nasopharynx, et pas plus de 10 secondes.
- La procédure doit permettre d’aspirer 2 à 5 ml de sécrétions. S’il n’a pas été possible d’obtenir cette quantité lors de la première aspiration, la procédure doit être répétée avec un lavage nasopharyngé en instillant 5 ml de sérum physiologique dans la même narine ou dans l’autre.
- Ne pas répéter la procédure plus de trois fois.
- La procédure doit être interrompue immédiatement en cas de :
- Détresse respiratoire ;
- Sueur profuse, nausées, vomissements, vertiges, étourdissements ou perte de connaissance.
Après la procédure
- Surveiller l’enfant pendant quelques minutes.
- Informer les parents ou la personne qui s’occupe de l’enfant que la toux peut être plus fréquente pendant les 24 heures qui suivent la procédure.
- Transférer la totalité de l’échantillon dans un contenant stérile (tube Falcon).
- Nettoyer le tube Falcon avec des compresses alcoolisées.
- Noter les informations suivantes sur l’échantillon : type et numéro de l’échantillon, date, heure, et volume total de l’échantillon.
- Placer l’échantillon dans un sac à échantillons, le fermer hermétiquement et faire en sorte qu’il soit prêt à être transporté.
Induction d’expectorations33
Généralités
L’induction d’expectorations est généralement effectuée chez les personnes de tous âges qui ne parviennent pas à produire spontanément des expectorations. Le patient inhale une solution saline hypertonique nébulisée qui permet de liquéfier les sécrétions des voies respiratoires, de favoriser la toux et de produire des expectorations de sécrétions respiratoires. Cette inhalation ne déclenche pas toujours la production d’expectorations chez les jeunes enfants. En l’absence de production d’expectorations, il est souvent nécessaire de recourir à une aspiration nasopharyngée pour collecter des expectorations.
L’induction des expectorations est considérée comme une procédure à faible risque pour l’enfant ou l’adolescent chez qui une tuberculose est recherchée. Les très rares effets indésirables signalés sont des quintes de toux, une respiration sifflante sans gravité et des saignements de nez. Elle peut être réalisée de manière sûre même chez les jeunes enfants, mais le personnel doit recevoir une formation et disposer du matériel spécialisé, et il convient de respecter les mesures de contrôle de l’infection.
Un examen des enfants et des adolescents doit être effectué à l’avance afin de s’assurer que leur état de santé permet la réalisation de cette procédure.
Contre-indications
L’induction des expectorations ne doit pas être réalisée dans les cas suivants :
- Enfant ou adolescent qui n’est pas à jeun depuis 3 heures ou plus ;
- Saturation en oxygène inférieure à 92 % à l’air ambiant ou présence d’une cyanose ;
- Détresse respiratoire sévère et résultats anormaux lors de la mesure des signes vitaux ;
- Respiration sifflante de modérée à sévère ;
- Toux sévère ;
- Saignements – numération des plaquettes basse ou présence d’une autre cause de saignement ;
- Baisse du niveau de conscience.
Matériel nécessaire
- Gants non stériles ;
- Masques de protection respiratoire filtrant les particules (N95 ou équivalent) ;
- Tablier jetable ;
- Lunettes de protection ;
- Salbutamol (100 μg/bouffée) ;
- Chambre d’inhalation ;
- Concentrateur d’oxygène avec masque ou canule nasale ;
- Oxymètre de pouls ;
- Nébuliseur avec sa tubulure ;
- Masques de nébulisation de différentes tailles ou embout buccal ;
- Filtre antibactérien ;
- Solution saline hypertonique stérile (3 à 5 %) ;
- Seringues de 5 à 10 ml ;
- Crachoir ;
- Machine d’aspiration ;
- Sonde nasogastrique (6 à 10 CH) et extracteur de mucus (6 à 8 G) stérile ;
- Un ou deux draps pour envelopper l’enfant ;
- Oxymétazoline (facultatif, pour la prévention des épistaxis) ;
- Solution saline stérile ;
- Coton ;
- Alcool ou chlorhexidine ;
- Désinfectant pour le matériel médical ;
- Récipient stérile pour échantillons avec bouchon à vis (tube Falcon) ;
- Formulaire de demande d’examen de laboratoire ;
- Marqueur ou stylo indélébile ;
- Savon antiseptique.
Procédure
L’induction des expectorations est effectuée par un(e) infirmier(ère) ou un clinicien d’une autre catégorie formé à la technique, et chez un enfant ou un adolescent à jeun depuis au moins 2 ou 3 heures. Les observations générales et l’auscultation pulmonaire doivent être consignées. La saturation en oxygène et le pouls doivent être surveillés tout au long de la procédure. La procédure doit être interrompue en cas de baisse de la saturation en dessous de 90 % et si le pouls est supérieur à 180 battements/minute ou inférieur à 100 battements/minute.
- Expliquer la procédure à l’enfant ou à l’adolescent et à ses parents ou à la personne qui s’occupe de lui (s’ils sont présents).
- Administrer un bronchodilatateur (par exemple, 200 μg de salbutamol administrés à l’aide d’un aérosol-doseur relié à une chambre d’inhalation) afin de prévenir la survenue d’une bronchoconstriction. Attendre 15 minutes avant de commencer la nébulisation.
- Remplir la coupelle du réservoir à médicaments du nébuliseur avec 10 ml de solution de chlorure de sodium à 5 %.
- Administrer une nébulisation de solution saline hypertonique (5 % de NaCl) pendant 15 minutes, ou jusqu’à ce que le réservoir soit vide.
- Si nécessaire, procéder à une séance de kinésithérapie respiratoire (clapping ou percussions de faible intensité sur le dos, la poitrine et les aisselles de l’enfant en mettant les mains en forme de coupe) afin de mobiliser les sécrétions.
- Pour les enfants plus âgés et les adolescents capables de produire des expectorations :
- Encourager l’enfant ou l’adolescent à cracher ses expectorations dans un crachoir, et continuer à le faire jusqu’à ce qu’il ne puisse plus en produire. Si l’échantillon obtenu ne convient pas (volume inférieur à 1 ml ou aspect de consistance aqueux, ce qui indique la présence de salive), procéder éventuellement à une nouvelle nébulisation.
- Si l’enfant ou l’adolescent ne tousse pas après la nébulisation, l’inviter à prendre une inspiration profonde ou à sauter ou courir sur place si son état clinique est stable et qu’il en est capable. Réaliser une percussion thoracique sur les parois antérieures et postérieures du thorax. Encourager l’enfant ou l’adolescent à cracher ses expectorations comme indiqué ci-dessus.
- Si le volume d’expectorations collecté est inférieur à 1 ou 2 ml, répéter la nébulisation avec 5 ml supplémentaires de solution de chlorure de sodium à 5 %, jusqu’à obtenir au moins 2 ml d’expectorations, en attendant au moins 30 minutes entre la fin d’une nébulisation et le début de la suivante. Ne pas effectuer plus de trois nébulisations consécutives en une seule séance.
- Fermer hermétiquement le crachoir.
- Veiller à ce que l’enfant ou l’adolescent porte un masque chirurgical avant de quitter la salle où sont réalisées les inductions d’expectorations.
- Pour les jeunes enfants qui ne sont pas capables de produire d’expectorations:
- Prélever des expectorations en réalisant une aspiration dans le nasopharynx à l’aide d’un extracteur de mucus ou d’une sonde nasogastrique stérile (voir la procédure à suivre pour l’aspiration nasopharyngée).
Tout le matériel qui sera réutilisé doit être désinfecté et stérilisé avant toute nouvelle utilisation avec un autre patient.
30 Adaptation des Lignes directrices concernant la prise en charge de la tuberculose chez l’enfant dans le cadre des programmes nationaux de lutte contre la tuberculose (deuxième édition). Genève, Organisation mondiale de la Santé, 2014 (2016 pour la traduction française).
31 Adaptation des Lignes directrices concernant la prise en charge de la tuberculose chez l’enfant dans le cadre des programmes nationaux de lutte contre la tuberculose (deuxième édition). Genève, Organisation mondiale de la Santé, 2014 (2016 pour la traduction française), et du document Standard operating procedures: collection, transport and processing of gastric aspirates. CaP-TB project.
32 Adaptation du document Standard operating procedures: collection, transport and processing of nasopharyngeal aspirates. CaP-TB project, et TB-Speed standard operating procedure nasopharygeal aspirate (NPA) collection, TBS_2P_SOP_BSC, version 1.0, 14/02/2019.
33 Adaptation des Lignes directrices concernant la prise en charge de la tuberculose chez l’enfant dans le cadre des programmes nationaux de lutte contre la tuberculose (deuxième édition). Genève, Organisation mondiale de la Santé, 2014 (2016 pour la traduction française), et du document Standard operating procedures: collection, transport and processing of gastric aspirates. CaP-TB project.
 Retour
Retour