Liens transversaux de livre pour 6.1 Drug safety and adverse drug reactions
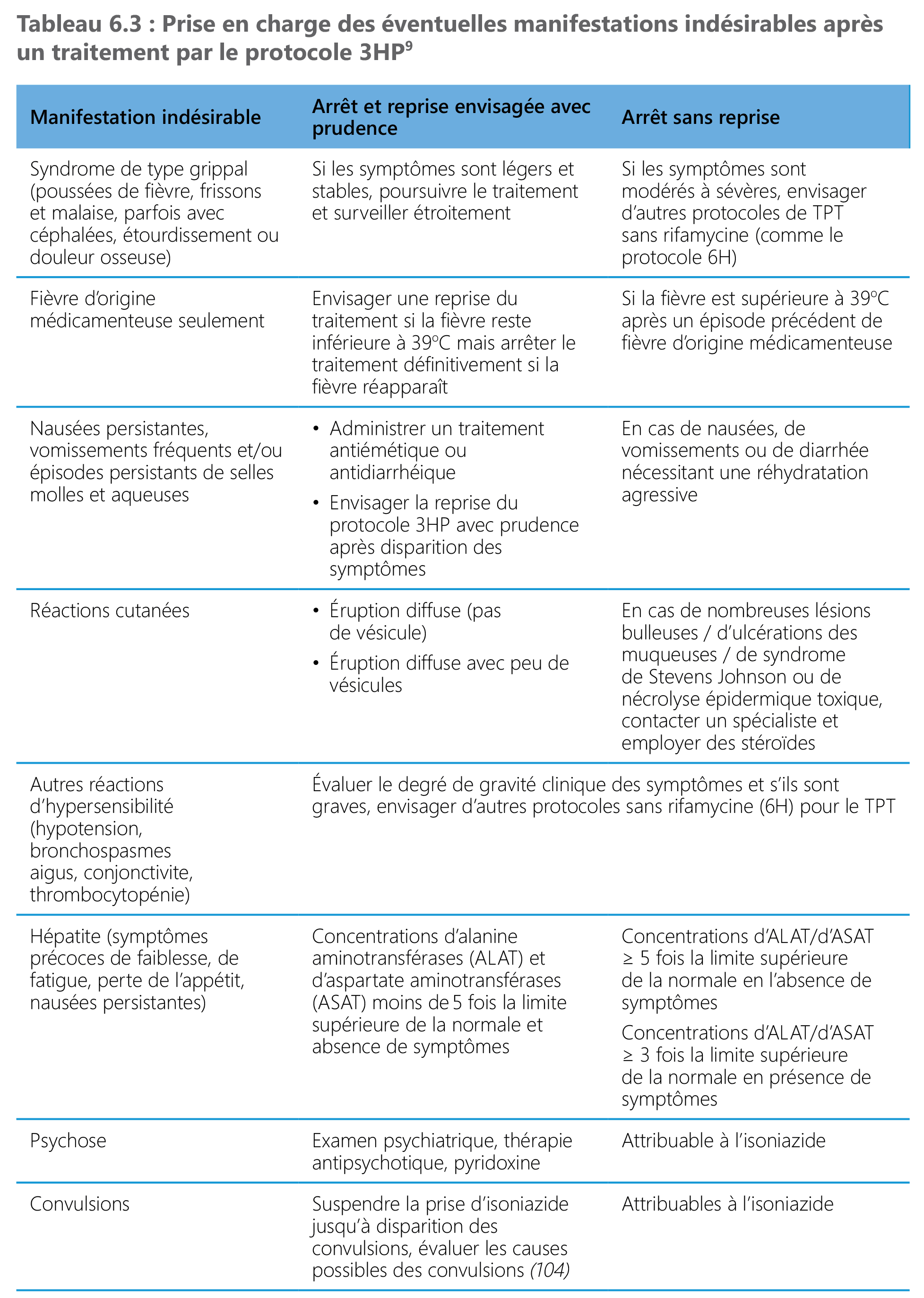
Prise en charge des manifestations indésirables
Pour des personnes recevant un TPT mais autrement en bonne santé, les manifestations indésirables pendant un traitement préventif doivent être minimisées. En cas de réaction indésirable grave, le TPT doit être interrompu immédiatement et des soins médicaux de soutien doivent être dispensés. Une prise en charge de préservation et une poursuite du traitement sous observation peuvent être envisagées en cas de manifestations indésirables légères à modérées, selon ce que le prestataire de soins de santé aura déterminé.
Si possible, la faculté d’appréciation du clinicien doit pouvoir s’exercer et des antécédents complets, notamment les médicaments et compléments administrés simultanément, doivent être relevés. Les étapes suivantes peuvent aider à évaluer les manifestations indésirables et à les prendre en charge.
1. Quel est le degré de gravité de la manifestation indésirable (légère, modérée, grave) ?
2. Quel est le degré de gravité de l’événement (c’est-à-dire susceptible de conduire au décès ou d’engager le pronostic vital de la personne ; hospitalisation ou prolongation de l’hospitalisation ; handicap profond persistant ; anomalie congénitale) ?
3. En quoi consiste la prise en charge immédiate (rassurer, traiter les symptômes, maintenir ou interrompre le TPT ou exiger une intervention pour éviter de graves conséquences) ?
4. Quelle est la cause sous-jacente (médicamenteuse, autres facteurs) ?
5. En quoi la manifestation indésirable aura-telle une incidence préjudiciable à l’observance du traitement à l’avenir (tolérance, remplacement envisagé par un autre protocole) ?
6. Quelle est la prochaine étape (poursuivre ou redémarrer, remplacer, suivre et évaluer de nouveau) ?
Point important : Les programmes nationaux sont encouragés à utiliser une technologie de communication, notamment par SMS et appels par vidéo, pour que le personnel soignant notifie le plus tôt possible une manifestation indésirable et intervienne rapidement. Il est conseillé de mettre un dispositif en place pour enregistrer les informations sur la survenue et la prise en charge des manifestations indésirables.
A. Isoniazide et rifampicine (64)
- Hépatite médicamenteuse
– Caractéristique indiquant la nécessité d’interrompre un traitement : Augmentation transitoire, asymptomatique du taux sérique de transaminases hépatiques survenant dans les premières semaines du traitement. Il n’est pas nécessaire d’interrompre ou de modifier le traitement, sauf en cas d’anorexie, de malaise, de vomissements ou de signes cliniques d’un ictère. Les caractéristiques cliniques inquiétantes sont les vomissements prolongés, les modifications mentales et des signes de saignement – tous ces signes évoquant une menace de lésion hépatique aiguë et nécessitant une interruption immédiate du traitement.
– Prise en charge d’un ictère et d’autres signes graves : Si l’ictère ou tout autre signe clinique évocateur d’une atteinte du foie aiguë se développe, interrompre tous les traitements jusqu’à disparition de l’ictère ou des symptômes hépatiques et jusqu’à ce que le taux d’enzymes du foie soit revenu au niveau de référence. S’il n’est pas possible de mesurer les enzymes du foie, mieux vaut attendre deux semaines après disparition de l’ictère pour commencer un TPT. D’autres causes d’hépatite doivent être explorées.
– Réintroduction : Une fois l’hépatite guérie, il est possible de réintroduire le même protocole thérapeutique, soit progressivement soit en une fois (“réexposition”). Cependant, si l’hépatite a engagé le pronostic vital et n’était probablement pas due à une autre cause (comme l’alcool ou une infection virale), il est probablement plus prudent de passer à un autre protocole thérapeutique.
- Réactions cutanées
– Démangeaison sans éruption ou avec légère éruption : Un traitement symptomatique par antihistaminiques peut être essayé tout en poursuivant le TPT.
– Démangeaison avec éruption modérée ou sévère : Si l’éruption est sévère ou en cas de signes évidents d’atteinte de la muqueuse, d’hypotension ou de maladie grave, un traitement par corticostéroïdes doit être envisagé. Du prednisolone par voie orale (40 à 60 mg) doit être administré chaque jour jusqu’à l’obtention d’une réponse. La dose doit alors être réduite graduellement dans les jours qui suivent, en fonction de la réponse clinique. Le TPT doit être suspendu jusqu’au complet apaisement de la réaction. Si la réaction cutanée initiale est sévère, la dose complète peut être augmentée progressivement par plus petites doses initiales provocatrices. En cas de réaction sévère, le médicament suspecté ne doit plus être administré et un autre protocole doit être envisagé.
– Les personnes atteintes de pellagre associée à l’isoniazide qui interrompent leur prise d’isoniazide et reçoivent un traitement à haute dose de nicotinamide (une forme de vitamine B3) peuvent guérir totalement, mais la pellagre peut entraîner une maladie grave ou un décès si elle n’est pas traitée (103). Le traitement recommandé contre une pellagre est la prise quotidienne de 300 mg de nicotinamide pendant trois ou quatre semaines. Les sources alimentaires de vitamine B3 sont les mêmes que pour la vitamine B6.
- Neuropathie périphérique
– Pour prévenir une neuropathie périphérique, administrer une dose quotidienne de 10 à 25 mg de vitamine B6 (pyridoxine) ou d’un complexe vitaminique B.
– En cas de neuropathie périphérique avérée, la pyridoxine doit être administrée chaque jour à plus fortes doses de 100 à 200 mg. Voir aussi le chapitre 5 pour obtenir davantage de détails sur la pyridoxine.
- Réactions gastro-intestinales à la rifampicine (douleur abdominale, nausées, vomissements) : Si les symptômes sont légers, l’épisode se résorbe généralement spontanément et il peut suffire de rassurer la personne. Si l’intolérance gastro-intestinale est suffisamment sévère pour risquer une interruption du traitement, suspendre la prise de rifampicine sur trois ou quatre doses, prendre des médicaments assurant un traitement symptomatique (comme de la métoclopramide pour contrer les vomissements) ou en dernier ressort, administrer la rifampicine avec de petites quantités d’aliments pour ne pas interrompre la prise du médicament. Bien que l’ingestion concomitante d’aliments réduise légèrement l’absorption de la rifampicine, il est préférable de reprendre la rifampicine.
- Léthargie : Rassurer.
- Coloration rouge ou orange des sécrétions biologiques (urine, larmes, sperme et sueur) : Rassurer.
B. Isoniazide et rifapentine
Veuillez noter : Les rifamycines sont de puissants inducteurs enzymatiques et tout effet secondaire doit être évalué et pris en charge en même temps que d’éventuelles interactions médicamenteuses (voir plus loin dans ce chapitre).
C. Surveillance systématique : elle doit inclure la tolérance et l’observance. Rechercher les éléments suivants à chaque entrevue avec la personne sous TPT,
- Signes ou symptômes de tuberculose-maladie (“échappée” ou diagnostic manqué au début du TPT).
- Grossesse : interrompre le protocole 3HP, envisager un autre protocole pour le TPT (par exemple triple association à doses fixes d’isoniazide, de vitamine B6 et de cotrimoxazole).
- Manifestation indésirable : type, survenue et durée, gravité.
- Évaluer l’observance du traitement et apporter le soutien nécessaire : toute interruption de traitement doit avoir été discutée avec la personne concernée et la personne qui l’appuie dans son traitement et des interventions doivent être mises en place pour résoudre les problèmes d’observance.
- Autres maladies comme le paludisme.
- Examen physique approprié.
- Vérifier les médicaments pris (y compris les traitements habituels) pouvant interagir avec le TPT.
- Tests de la fonction hépatique (TFH) sur des personnes qui présentaient des niveaux de référence élevés ou lors d’une visite précédente ; avec antécédents de consommation régulière d’alcool. Les TFH systématiques ne sont pas indiqués lorsqu’un traitement préventif à l’isoniazide est administré pendant une grossesse, à moins qu’il y ait d’autres facteurs de risque d’hépatotoxicité.
Point important : Les TFH ne sont pas indiqués systématiquement avant de commencer un TPT. Les TFH de référence et de suivi ne sont nécessaires que si un risque est identifié, comme une anomalie dysfonctionnelle hépatique préexistante, une cirrhose du foie ou d’autres pathologies.
Les programmes nationaux doivent mettre un dispositif en place pour l’enregistrement systématique de toute manifestation indésirable signalée par des personnes sous TPT. Outre une prise en charge rapide, des réactions médicamenteuses indésirables suspectées ou confirmées doivent aussi être notifiées aux autorités nationales chargées de la pharmacovigilance, conformément à la réglementation. Il convient de procéder périodiquement à l’examen des dossiers de cas pour déterminer les types les plus fréquents de manifestations indésirables et adapter l’application des programmes en vue de les minimiser.
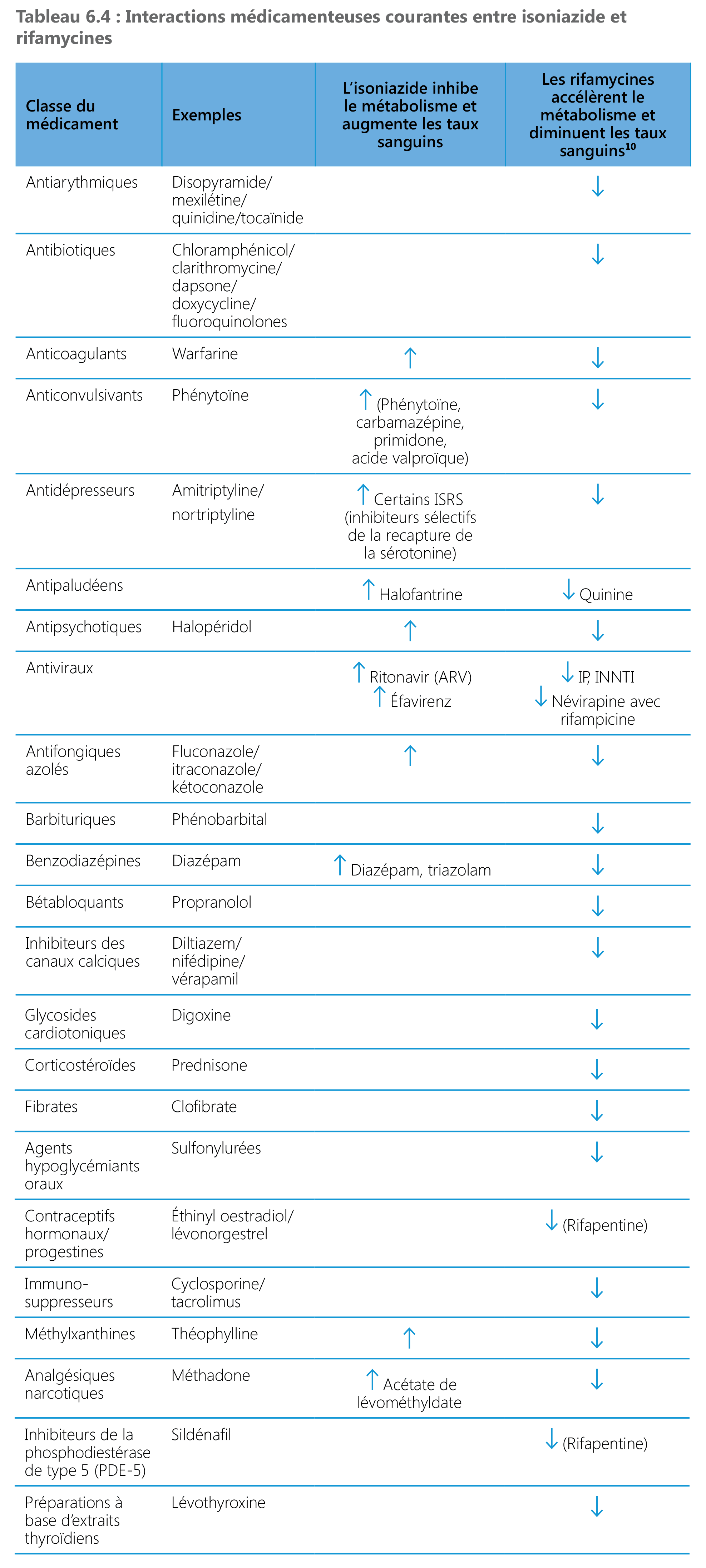
Interactions médicamenteuses
Les rifamycines et les ARV
Lorsque les rifamycines et les ARV sont administrés simultanément, l’effet de l’un de ces médicaments peut se trouver modifié dans l’organisme. Une interaction médicamenteuse peut intensifier ou diminuer l’action de l’un ou l’autre de ces médicaments, réduire son efficacité ou provoquer des manifestations indésirables. Les rifamycines sont de puissants inducteurs des enzymes métabolisantes, notamment les enzymes du cytochrome P450 (CYP) ; elles peuvent donc perturber l’activité des médicaments qui dépendent de cette voie métabolique en accélérant leur élimination. La rifampicine en particulier est un puissant inducteur des enzymes 1A du CYP 450 hépatique (principalement les sous-familles 3A et 2C), de la glycoprotéine-P (P-gp) et de l’uridine 5’-diphospho-glucuronosyltransférase (UGT). De même, la rifapentine est un inducteur des enzymes du CYP450, en particulier des isoenzymes des CYP3A4, CYP2C8, et CYP2C9 (105). La rifampicine et la rifapentine ont la même activité d’induction tandis que la rifabutine est un inducteur moins puissant. En conséquence, les rifamycines accélèrent le métabolisme de nombreux médicaments administrés simultanément, comme certains ARV. C’est pourquoi la co-administration de ces ARV et d’un médicament de la classe des rifamycines peut diminuer la biodisponibilité des ARV et accentuer le risque d’échec du traitement anti-VIH ou la résistance à ces traitements. Les ARV les plus touchés par l’induction du CYP 450 due aux rifamycines sont les inhibiteurs de la protéase (IP), les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), les inhibiteurs de transfert de brin de l’intégrase (INSTI) (comme le dolutégravir) et les antagonistes compétitifs du récepteur CCR5 (comme le maraviroc). Les rifamycines et de nombreux autres médicaments présentés dans le Tableau 6.4. se perturbent aussi mutuellement. Une décision clinique pertinente est donc indispensable lorsque ces médicaments doivent être administrés simultanément avec un TPT contenant de la rifamycine, soit en évitant ces protocoles soit en ajustant la dose des autres médicaments (106).
En général, il faut être prudent lorsqu’on prescrit des protocoles thérapeutiques contenant de la rifampicine et de la rifapentine à des personnes vivant avec le VIH et traitées par ARV. Ces protocoles ne doivent pas être administrés aux personnes vivant avec le VIH et suivant un protocole contenant des inhibiteurs de la protéase ou de la névirapine. Même s’il n’est pas nécessaire d’ajuster la dose lorsqu’on administre de la rifampicine en association avec l’éfavirenz, la dose de dolutégravir doit être augmentée jusqu’à 50 mg deux fois par jour pour les adultes lorsqu’il est administré simultanément avec la rifampicine (107). Cette dose est bien tolérée et tout aussi efficace dans la suppression de la charge virale et dans la restauration des lymphocytes CD4+, comparé à l’éfavirenz (108). Le protocole 3HP peut être administré aux personnes traitées par un TARV contenant de l’éfavirenz sans qu’il soit nécessaire d’ajuster la dose (109). L’administration de rifapentine en association avec le raltégravir est également sans risque et bien tolérée (110).
Co-administration de rifapentine et de dolutégravir
Même si l’on sait que la rifapentine administrée une fois par semaine réduit l’activité du dolutégravir, la concentration sanguine du dolutégravir reste supérieure aux concentrations cibles pour la suppression de la charge virale chez les adultes qui prennent ces deux médicaments. Une étude a montré qu’il est peu probable qu’une réduction de la concentration du dolutégravir (même de 75 à 80 %) soit significative d’un point de vue clinique car même une dose de 10 mg de dolutégravir prise une fois par jour (simultanément au squelette d’un inhibiteur nucléotidique de la transcriptase inverse (INTI)) produit des taux élevés de suppression de la charge virale sur 96 semaines, comme le protocole contenant de l’éfavirenz (111). Le dolutégravir peut donc être administré simultanément avec la rifapentine en prise hebdomadaire sans aucune modification de dose.
On a démontré aussi que l’administration concomitante de ces médicaments était globalement sans risque. Des essais de phase I/II du protocole 3HP et du dolutégravir chez des adultes infectés par le VIH avec une charge virale supprimée ont montré une bonne tolérance et le maintien d’une charge virale indétectable. Aucune manifestation indésirable de grade 3 n’a été signalée et selon les conclusions, il n’était pas nécessaire d’ajuster la dose de dolutégravir chez les adultes vivant avec le VIH et sous un TARV contenant du dolutégravir (112).
Toutefois, d’autres études de pharmacocinétique doivent être menées sur le protocole thérapeutique 3HP administré simultanément avec d’autres médicaments, en particulier des inhibiteurs de la protéase (IP) boostés et le ténofovir alafénamide, notamment aux femmes enceintes et aux enfants. Des études sont en cours pour évaluer les concentrations de dolutégravir associées à la prise quotidienne de rifapentine et la nécessité d’ajuster la dose de dolutégravir avec le protocole 1HP pour adultes et enfants. (ACTG 5372).
Différentes options d’ARV pour l’administration concomitante d’un TPT contenant un médicament de la classe des rifamycines.
Une modification d’un TARV pour l’adapter à un certain protocole de TPT doit être réalisée avec la plus extrême prudence. Le clinicien doit sérieusement peser les risques et les avantages d’une telle modification car des changements fréquents dans un TARV entraînent une perte de contrôle virologique et doivent donc être évités dans la mesure du possible, en particulier lorsque la charge virale de la personne est supprimée par le TARV en cours. De plus, il n’est pas idéal de passer à un TARV contenant de l’éfavirenz dans de nombreuses régions enregistrant des taux élevés de résistance aux INNTI (notamment dans de nombreuses régions de l’Afrique subsaharienne). Globalement, un TARV réussi doit être prioritaire dans la décision sur le choix du protocole de TPT. Les options suivantes existent si l’on envisage de changer le protocole de TARV pour une utilisation compatible avec un TPT contenant un médicament de la classe des rifamycines.
- La plupart des inhibiteurs nucléotidiques de la transcriptase inverse (INTI) et des inhibiteurs de fusion ne perturbent pas de manière significative l’activité des médicaments de la classe des rifamycines.
- Les données pharmacocinétiques ne font pas apparaître d’interactions significatives entre la rifapentine et l’éfavirenz de la classe des INNTI (113–115) et le raltégravir de la classe des INTI (110).
- Aucune interactions médicamenteuse significative n’est signalée dans l’utilisation de la rifapentine avec des TARV contenant de l’abacavir (ABC), de l’emtricitabine (FTC), du ténofovir disoproxil fumarate (TDF), de la lamivudine (3TC) ou de la zidovudine (AZT). Les protocoles contenant de l’éfavirenz ou du raltégravir utilisés en association avec soit l’ABC/3TC ou le TDF/FTC peuvent être utilisés avec le protocole 3HP.
Le ténofovir alafénamide fait notablement exception car étant un substrat de la glycoprotéine P (P-gp), il peut en résulter une exposition médicamenteuse inacceptablement faible due à un médicament de la classe des rifamycines comme la rifapentine. Il convient donc d’éviter l’administration concomitante de ténofovir alafénamide et de rifapentine jusqu’à ce que l’on dispose de suffisamment de données pour appuyer leur utilisation simultanée (116). Fait notable, l’administration concomitante de ténofovir alafénamide et de rifampicine produit des concentrations intracellulaires semblables du médicament actif, le ténofovir diphosphate (TDF-DP) comme le TDF administré seul, ce qui suggère que cette association pourrait être utilisée mais les données cliniques susceptibles de le confirmer sont rares (117).
Isoniazide
L’isoniazide est connu pour être un inhibiteur de certaines enzymes du cytochrome P450. La co-administration d’isoniazide et de médicaments subissant une biotransformation au travers de ces voies métaboliques peut réduire leur élimination, augmentant de ce fait la concentration/l’exposition du médicament. C’est pourquoi il peut être indispensable d’ajuster les dosages de médicaments métabolisés par ces enzymes lors d’un début ou d’une interruption simultanée de traitement pour maintenir les taux sanguins thérapeutiques au niveau optimal. On a signalé que l’isoniazide inhibait le métabolisme des médicaments suivants : éfavirenz, anticonvulsivants, benzodiazépines, halopéridol, kétoconazole, théophylline et warfarine. On ne connaît pas l’impact des effets concurrents de la rifampicine et de l’isoniazide sur le métabolisme de ces médicaments mais les effets inducteurs de la rifampicine tendent à prédominer. Des interactions médicamenteuses semblables des rifamycines sont résumées dans le Tableau 6.4.
Points importants
- La coadministration d’ARV couramment utilisés et d’un TPT est sans risque et des variantes sont disponibles lorsque l’on suspecte qu’une faible exposition aux ARV est due à une interaction médicamenteuse.
- Il convient d’être prudent lorsqu’une personne recevant un TPT est aussi traitée pour une comorbidité.
- Lorsqu’elles reçoivent un TPT contenant un médicament de la classe des rifamycines, les femmes utilisant des contraceptifs hormonaux doivent utiliser en supplément un contraceptif barrière pour éviter une grossesse.
TPT contenant un médicament de la classe des rifamycines et traitement antipaludique
La rifampicine et d’autres médicaments de la classe des rifamycines étant de puissants inducteurs du CYP3A4, diminuent l’exposition à la quinine chez les adultes sous traitement antipaludique, ce qui aboutit à un taux de recrudescence cinq fois supérieur (64). De même, leur administration concomitante avec la méfloquine entraîne une baisse de l’exposition à la méfloquine trois fois plus importante. Une diminution semblable dans les niveaux d’exposition a été signalée lors de la co-administration de rifampicine et d’artéméther, de dihydroartémisinine et de luméfantrine (diminution respectivement 9, 6 et 3 fois plus importante). On ne dispose pas de suffisamment de données probantes pour modifier les recommandations actuelles sur le dosage en mg/kg de poids corporel de ces antipaludéens ; il faut donc surveiller étroitement le risque plus élevé de recrudescence. Les recommandations suivantes peuvent être appliquées jusqu’à ce que des données clairement probantes soient disponibles sur les façons d’améliorer l’exposition aux antipaludéens :
- Si le paludisme est diagnostiqué chez une personne qui n’est pas encore sous un TPT comportant un médicament de la classe des rifamycines, l’épisode palustre doit être considéré prioritaire et traité en premier.
- Si le paludisme est diagnostiqué chez une personne recevant un TPT comportant un médicament de la classe des rifamycines, le traitement antipaludique doit commencer simultanément avec une surveillance clinique, conformément aux directives nationales pour s’assurer que le paludisme est guéri. On ne dispose pas de suffisamment de données probantes pour indiquer que les doses de TPT ou d’ACT (association médicamenteuse comportant de l’artémisinine) doivent être ajustées.
- Si l’on constate une récidive chez une personne recevant un TPT, un traitement antipaludique doit être repris conformément aux directives nationales. Le traitement préventif doit être suspendu uniquement si le nouveau traitement antipaludique comporte aussi des médicaments dont on connaît les interactions avec les rifamycines. Le TPT pourra reprendre dès que l’épisode palustre aura pris fin.
- Si une personne présente les critères de diagnostic d’un cas sévère de paludisme (altération de la conscience, hypoglycémie, taux élevé de bilirubine/ictère, saignements, anémie, insuffisance rénale et parasitémie supérieure à 10 %) le TPT doit être suspendu et la personne doit être traitée d’urgence conformément aux directives nationales. Le TPT ne sera repris que lorsque l’épisode palustre aura pris fin.
Pendant combien de temps un TPT protège-t-il une personne ?
La durée de la protection contre la tuberculose dépend à la fois de la puissance du protocole du TPT pour stériliser l’infection tuberculeuse et du risque de réinfection à la suite du traitement. Une infection tuberculeuse insuffisamment traitée en raison d’un protocole moins puissant ou d’une mauvaise observance du traitement peut récidiver et évoluer vers une tuberculose-maladie.
Les personnes vivant avec le VIH sont exposées à un risque élevé de récidive de l’infection tuberculeuse et, une fois infectées, au risque d’évolution vers la tuberculose-maladie. Avant l’introduction des TARV, plusieurs études ont constaté une escalade du risque de tuberculose à la suite d’un TPT dans des pays supportant une lourde charge de tuberculose et, au contraire, une protection plus durable dans les pays où la charge de la tuberculose est faible ou modérée, avec une baisse de la mortalité et de l’incidence des cas de tuberculose. Des essais récents réalisés dans une période où les TARV étaient accessibles à grande échelle cependant, ont conclu que la protection assurée par le TPT même dans des zones à forte charge de tuberculose, pouvait durer aussi longtemps que dans les pays où la charge de la tuberculose est faible ou modérée.
- En Côte d’Ivoire, où l’incidence des cas de tuberculose a été déclarée récemment de 159 cas pour 100 000 habitants, un traitement préventif à l’isoniazide pendant six mois a eu un effet protecteur notable puisque la mortalité a baissé chez les personnes infectées par le VIH qui avaient commencé un TARV même lorsque la numération des CD4 était élevée, et l’effet protecteur a duré pendant six années (118).
- Au Brésil (prévalence moyenne de la tuberculose), le traitement préventif à l’isoniazide a considérablement réduit le risque de tuberculose chez les patients infectés par le VIH dont le test cutané à la tuberculine a été positif. Un traitement de six mois à l’isoniazide a réduit le risque de tuberculose pendant plus de sept années, contrairement aux résultats d’études menées dans des pays d’Afrique à forte charge de morbidité où l’incidence des cas de tuberculose a augmenté immédiatement à la suite d’un traitement préventif à l’isoniazide (119,120).
- De récentes études menées au Myanmar et en Indonésie (forte charge de tuberculose) ont confirmé la longue durée de la protection obtenue par un traitement préventif à l’isoniazide de six mois chez les personnes vivant avec le VIH. Au Myanmar, un traitement préventif à l’isoniazide intégralement achevé a considérablement réduit le risque de tuberculose-maladie et de décès pendant huit années. En Indonésie, l’effet protecteur a duré plus de cinq ans (121,122).
- Au cours de l’essai BRIEF-TB (97 % de participants issus de pays à lourde charge de tuberculose), l’incidence des cas de tuberculose à la suite d’un TPT complet comportant une association d’isoniazide et de rifapentine pendant un mois ou un protocole d’isoniazide seul pendant neuf mois est restée stable tout au long des trois années de suivi de l’essai. Dans cet essai, presque toutes les personnes vivant avec le VIH ont reçu un TARV. (54). Parmi les sujets qui sont des contacts domestiques de patients tuberculeux recevant un TPT dans la période précédant l’infection à VIH, il a été démontré qu’un traitement préventif à l’isoniazide avait un effet protecteur de longue durée même dans les pays enregistrant des taux très élevés de tuberculose-maladie.
- Dans les années 60, les services de santé publique des États-Unis d’Amérique ont parrainé plusieurs études pour évaluer l’efficacité d’un traitement préventif à l’isoniazide. Ces études ont porté, en Alaska, sur un large groupe de personnes à risque de tuberculose du fait d’un contact récent ou antérieur avec un patient atteint de tuberculose pulmonaire (123). En 1958, 2 % de la population dans cette zone était déclarée tuberculeuse et une étude à la tuberculine a révélé un taux annuel moyen d’infection tuberculeuse de 8 %. Ces niveaux sont parmi les niveaux les plus élevés jamais déclarés, encore plus que dans les pires contextes de transmission, comme dans les mines d’Afrique du Sud, où ces niveaux étaient estimés de 4,2 % en 2005 (124). Les participants ont reçu 300 mg par jour d’isoniazide ou 5 mg/kg pour les enfants ou un placebo équivalent pendant une année. Un suivi actif a été réalisé pendant deux ans et a été suivi de notifications passives pendant les dix années suivantes. Les données de suivi d’une étude réalisée dans 28 villages et deux pensionnats en Alaska à partir de 1958 ont montré que l’effet protecteur de l’isoniazide avait persisté pendant 19 ans (125). Le calcul ayant déterminé qu’un traitement préventif de six à neuf mois était optimal était dérivé des données de suivi de cette étude et d’une étude de l’Union internationale contre la tuberculose et les maladies respiratoires qui avait conclu que l’administration d’isoniazide pendant plus de neuf mois n’avait pas amélioré l’efficacité du traitement (69,126).
- Un examen systématique publié en 1999 (127) a permis de réaffirmer l’efficacité de l’isoniazide pour prévenir le développement d’une tuberculose-maladie parmi environ 60 % des individus dans divers groupes à risque, notamment des sujets contacts dans les familles. Un cas de tuberculose-maladie a été évité pendant cinq ans pour 35 sujets contacts domestiques récents d'un patient tuberculeux ayant donné un résultat positif au test cutané à la tuberculine et auxquels on a prescrit un traitement à l’isoniazide de six mois.
Quand faut-il répéter ou relancer un TPT ?
On ne dispose à ce jour d’aucune donnée probante sur l’utilité de répétitions d’un TPT. C’est la raison pour laquelle les lignes directrices 2020 de l’OMS sur les TPT ne recommandent pas particulièrement la répétition d’un TPT. Cependant, dans des contextes de forte transmission de tuberculose (telle que définie par les autorités locales) un traitement de 36 mois à l’isoniazide (comme indicateur pour une thérapie à vie) est recommandé aux personnes vivant avec le VIH (voir la recommandation ci-dessous). L’un des domaines prioritaires de la recherche dans ce type de contextes doit permettre de déterminer s’il est nécessaire de répéter les traitements par protocoles de courte durée et si oui, à quelle fréquence.
Recommandation de l’OMS :
18. Dans les régions où la transmission de la tuberculose est intense, les adultes et les adolescents vivant avec le VIH et dont le test de dépistage de l’infection tuberculeuse latente est positif ou non connu mais pour lesquels une tuberculose-maladie est improbable doivent recevoir un traitement préventif à l’isoniazide (TPI) chaque jour pendant au moins 36 moins. Un TPI doit être administré pendant 36 mois, que la personne soit sous TARV ou non et indépendamment de son degré d’immunosuppression, des antécédents de traitement antituberculeux et d’une grossesse dans des régions considérées enregistrer une forte transmission de tuberculose telle que définie par les autorités nationales.
Un essai pragmatique randomisé (WHIP3TB) réalisé parmi des personnes vivant avec le VIH et sous TARV en Éthiopie, au Mozambique et en Afrique du Sud et achevé fin 2019, a consisté à comparer l’efficacité du protocole thérapeutique 3HP administré en une seule fois (N=1802) ou deux fois (N=1808) sur 14 mois à l’efficacité d’un seul traitement utilisant le protocole 6H (N=404). L’achèvement du traitement était meilleur avec le protocole 3HP qu’avec le 6H. Un suivi de 24 mois après randomisation a montré la même incidence des cas de tuberculose, la même incidence des cas de tuberculose résistante à la rifampicine et les mêmes taux de mortalité parmi les participants recevant le protocole 3HP en une ou deux fois ; on a pu en déduire que le protocole 3HP protège les personnes vivant avec le VIH et recevant un TARV dans les régions à forte transmission de tuberculose et que la répétition de ce traitement chaque année n’en a pas amélioré les bienfaits (128). Il sera important d’assurer un suivi de plus longue durée de cet essai pour comprendre la durée de cet effet.
Une répétition du TPT doit toutefois être envisagée pour les personnes VIH-positives ou VIH-négatives qui ont achevé auparavant un TPT mais qui se sont trouvées par la suite en contact domestique ou étroit avec un patient tuberculeux. Puisque les tests disponibles actuellement (TCT ou IGRA) ne donnent pas de résultats négatifs après un TPT complet, ils ne peuvent pas être utilisés pour déterminer l’admissibilité de ces personnes à une répétition du TPT en cas de nouvelle exposition ou de réinfection. Il convient donc de procéder à une évaluation soigneuse de l’intensité de l’exposition et du rapport entre bienfaits et méfaits pour orienter la décision de répéter le TPT.
Il peut être nécessaire de relancer un TPT après une longue interruption du traitement. Le chapitre 5 (Tableau 5.3) et le chapitre 7 (Tableau 7.1) proposent plusieurs seuils pour identifier les échecs dans le suivi de différents protocoles thérapeutiques fondés sur les critères appliqués dans les essais. C’est là un autre domaine dans lequel nous manquons de données factuelles fiables sur “l’annulation” de l’interruption du protocole.
Un TPT peut-il entraîner une pharmacorésistance ?
L’une des préoccupations exprimées le plus souvent en relation avec un TPT utilisé à grande échelle est le risque de propagation d’une pharmacorésistance. Et à ce jour, aucune donnée probante très fiable n’a pu étayer de telles préoccupations (58). Les multiples essais réalisés ne sont pas parvenus à trouver des preuves scientifiques d’une association marquée entre une pharmacorésistance de la tuberculose et l’utilisation d’isoniazide ou d’une rifamycine dans les TPT (129,130). De telles préoccupations ont effectivement privé d’innombrables habitants des bienfaits d’une intervention pouvant être d’importance vitale. Dans la plupart des cas, la pharmacorésistance découle de traitements antituberculeux insuffisants. L’augmentation d’une pharmacorésistance est improbable si les programmes se conforment aux bonnes pratiques de TPT, en d’autres termes si le TPT est administré à des personnes indemnes de tuberculose-maladie. Les sujets atteints d’infection tuberculeuse sont porteurs d’un petit nombre de bactéries à réplication lente et il y a donc un faible risque de sélection de souches pharmacorésistantes pour un TPT (129). Au contraire, un TPT peut effectivement diminuer la charge globale de tuberculose-maladie et réduire ainsi le nombre de personnes susceptibles de recevoir un traitement antituberculeux insuffisant qui favorise l’émergence et la propagation d’une tuberculose MR.
Avant de lancer un TPT, l’éventualité d’une tuberculose-maladie doit être exclue au moyen des outils disponibles et un suivi régulier doit être assuré pour favoriser l’observance du TPT et l’identification précoce des symptômes de la tuberculose en cours de traitement. Il est possible aussi de renforcer la surveillance d’une pharmacorésistance chez les personnes qui développent une tuberculose confirmée par analyses microbiologiques pendant ou après un TPT.
Point important : La croyance répandue que l’utilisation du TPT à grande échelle favorise la pharmacorésistance n’est étayée par aucune donnée factuelle fiable et constitue le type d’obstacles qui empêchent les populations vulnérables d’accéder à des interventions capables de les protéger ainsi que leur communauté d’une tuberculose-maladie et de décès qui pourraient être évités.
Résistance à l’isoniazide à la suite d’un TPI
Dans un examen systématique de 13 études publiées depuis 1951 qui ont porté sur 18 095 personnes sous TPI et sur 17 985 cas témoins, rien ne suggérait un risque accru de tuberculose résistante à l’isoniazide à la suite d’un TPI ; ces résultats étaient semblables après stratification sur le VIH (129). De plus, dans la cohorte de l’étude de Thibela en Afrique du Sud, les pourcentages d’épisodes de tuberculose avec pharmacorésistance chez des patients ayant reçu un TPI n’étaient pas si différents des pourcentages obtenus dans les groupes témoins (131).
Résistance aux rifamycines à la suite d’un TPT
Une analyse de six essais contrôlés randomisés sur des protocoles de TPT contenant un médicament de la classe des rifamycines comparés à un groupe témoin ou à un groupe sous placébo a montré que la survenue de cas résistants à la rifampicine était de 0,09 % parmi 6808 sujets recevant un TPT comportant un médicament de la classe des rifamycines contre 0,01 % parmi 7415 sujets recevant d’autres protocoles (RR = 3,45, IC de 95 % (0,72–16,56) ; P = 0,12) (130). Dans trois de ces études dans lesquelles des TPT intermittents contenant un médicament de la classe des rifamycines ont été utilisés, deux cas de résistance à la rifampicine ont été trouvés parmi les 4673 sujets sous protocole intermittent contenant un médicament de la classe des rifamycines comparé à un cas de résistance à la rifampicine parmi 4427 sujets sous protocoles témoins (RR = 3,89 ; IC de 95 % (0,44–34,56) ; P = 0.22). Dans les essais sous placébo, aucun cas de résistance à la rifampicine n’a été trouvé parmi les participants recevant des protocoles comportant un médicament de la classe des rifamycines tandis que plusieurs cas de résistance à la rifampicine sont survenus dans le groupe sous placébo (RR 0,20 ; IC de 95 % (0,02–1,66)) (130).
ᵃ H-isoniazide, R-rifampicine, P-rifapentine
ᵇ Manifestation indésirable de grade 3 : manifestation importante d’un point de vue médical mais pas immédiatement mortelle. Manifestation indésirable de grade 4 : manifestation mortelle.
⁹ La plupart des manifestations indésirables d’origine médicamenteuse associées aux protocoles HP sont légères, se résorbent spontanément et ne laissent pas de séquelles.
¹⁰ Pour de nombreux agents, l’amplitude peut dépendre de la dose quotidienne des rifamycines comparé à une dose hebdomadaire (rifapentine).
 Retour
Retour