Enlaces transversales de Book para 6.1 Drug safety and adverse drug reactions
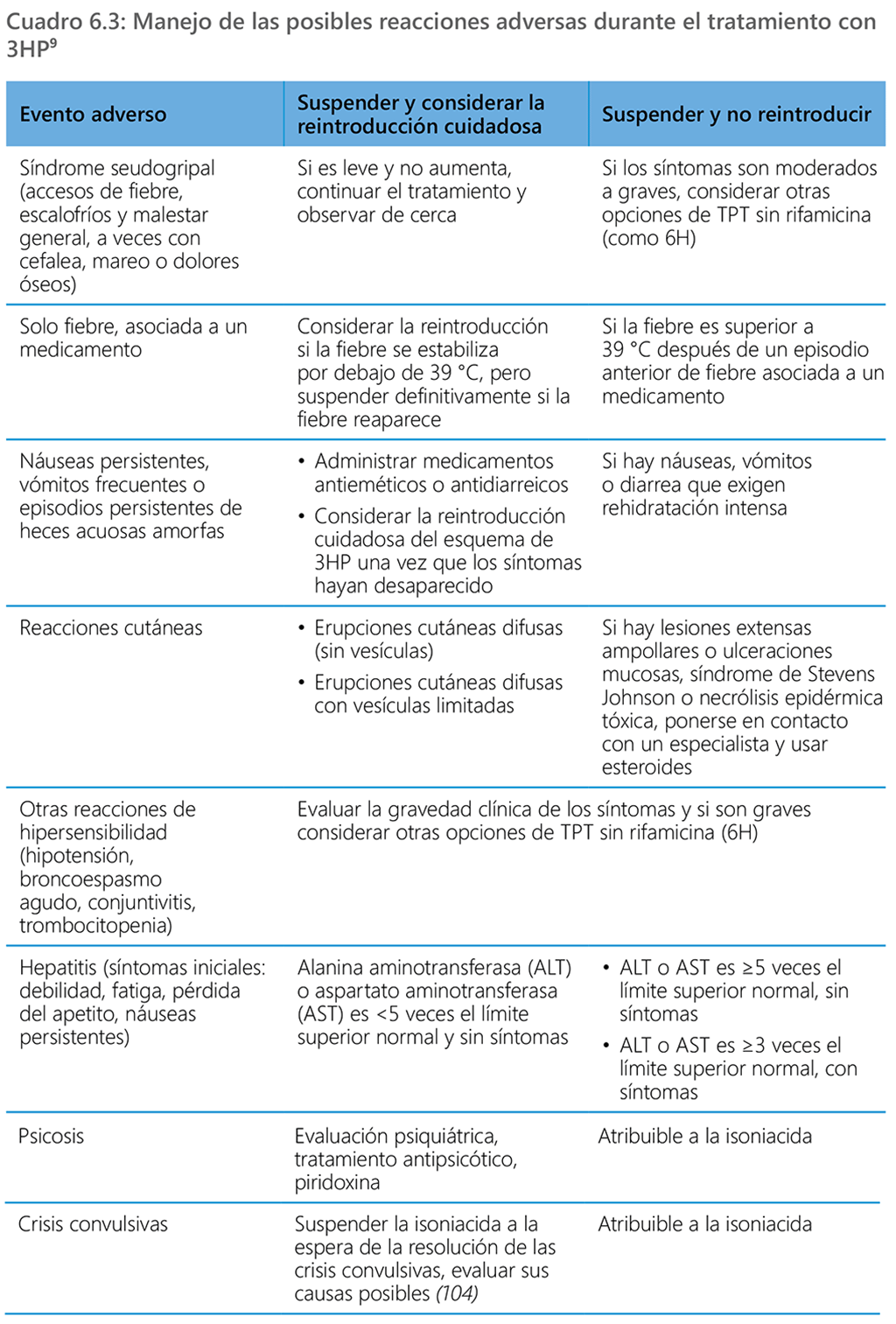
Manejo de los eventos adversos
Las personas que reciben TPT son por lo demás sanas y, por lo tanto, es necesario reducir al mínimo los eventos adversos durante el tratamiento preventivo. Si se presenta una reacción adversa grave, se tiene que suspender de inmediato el TPT y prestar atención médica de sostén. Se puede considerar el manejo conservador y la observación continua en el caso de eventos adversos leves o moderados, según lo determine el prestador de atención de salud.
Cuando esté disponible, se debe recurrir a un criterio médico y es necesario realizar una anamnesis completa que incluya los medicamentos y los suplementos concomitantes. Los pasos enumerados a continuación pueden facilitar la evaluación y las medidas para el manejo de los eventos adversos.
- ¿Qué intensidad tiene el evento adverso (leve, moderada, grave)?
- ¿Qué tan grave es el evento (es decir, es probable que dé lugar a la muerte; una experiencia que ponga en peligro la vida; exija hospitalización o prolongación de la hospitalización; una discapacidad importante persistente o anomalías congénitas)?
- ¿Cuál es la medida inmediata (tranquilizar, aliviar los síntomas, suspender o discontinuar el TPT o requiere una intervención para evitar desenlaces graves)?
- ¿Cuál es la causa subyacente (se relaciona con los medicamentos u otros factores)?
- ¿Cómo afectará el evento adverso la adhesión futura (tolerabilidad, considerar una sustitución por otro esquema)?
- ¿Cuál es el paso siguiente (continuar o reiniciar, sustituir, dar seguimiento y reevaluar)
Punto clave: Se alienta a los programas nacionales a que utilicen las tecnologías de la comunicación como los mensajes de texto y la comunicación por video para la notificación temprana de los eventos adversos y la pronta adopción de medidas por parte de los trabajadores de salud. Se aconseja la creación de un mecanismo de registro de datos sobre la aparición y el manejo de los eventos adversos.
A. Isoniacida y rifampicina (64)
- Hepatitis inducida por medicamento.
- Manifestaciones que indican la necesidad de dejar de tomar el medicamento: Durante las primeras semanas de tratamiento ocurren aumentos transitorios y asintomáticos de las transaminasas hepáticas séricas. No es necesario interrumpir ni cambiar el tratamiento a menos que haya anorexia, malestar general, vómito o ictericia clínicamente observable. Entre las manifestaciones clínicas preocupantes figuran los vómitos prolongados, los trastornos mentales y los signos de hemorragia, todos los cuales son indicativos de insuficiencia hepática aguda inminente y requieren la interrupción inmediata del tratamiento
- Manejo de la ictericia y otras manifestaciones graves: Si aparece ictericia o cualquier rasgo clínico indicativo de insuficiencia hepática aguda, es necesario suspender todos los medicamentos hasta que haya desaparecido la ictericia o los síntomas hepáticos y las enzimas hepáticas hayan regresado a las cifras basales. Si no se pueden medir las enzimas hepáticas, es conveniente esperar dos semanas después que de que haya desaparecido la ictericia, antes de iniciar el TPT. Deben investigarse otras causas de hepatitis.
- Reintroducción: Una vez que la hepatitis ha desaparecido, puede reintroducirse el mismo esquema terapéutico, ya sea de forma gradual o de una sola vez (“nueva provocación”). Sin embargo, si la hepatitis ha puesto en peligro la vida y es poco probable que haya sido originada por otra causa (como el alcohol o una infección viral), probablemente es más seguro cambiar a otro esquema.
- Reacciones cutáneas
- Prurito sin erupción cutánea o con una erupción leve: Se puede intentar un tratamiento sintomático con antihistamínicos y continuar el TPT.
- Prurito con erupción cutánea moderada o grave: Si la erupción cutánea es grave o si hay signos de afectación de las mucosas, hipotensión o enfermedad grave, se debería considerar la posibilidad de un tratamiento con corticosteroides. Se debe administrar prednisolona oral (40-60 mg) diaria hasta que haya una respuesta; la dosis se debe disminuir de forma gradual en los días siguientes según la respuesta clínica. Se debe suspender el TPT hasta que la reacción haya desaparecido por completo. Si la reacción cutánea inicial fue grave, la dosis completa se puede alcanzar, empezando progresivamente con dosis de exposición más bajas. Si ocurre una reacción grave, no debe administrase de nuevo el medicamento presunto y se debe considerar un esquema diferente.
- Las personas con pelagra atribuida a la isoniacida que discontinúan el fármaco y reciben tratamiento con nicotinamida en dosis altas (una forma de vitamina B3) se recuperan por completo, pero si no se trata, la pelagra puede provocar una enfermedad grave o la muerte (103). El tratamiento recomendado de la pelagra es 300 mg de nicotinamida diariamente durante tres a cuatro semanas. Las buenas fuentes alimentarias de vitamina B3 son similares a las fuentes de vitamina B6.
- Neuropatía periférica
- Para prevenir la neuropatía periférica, administrar una dosis diaria de 10-25 mg de vitamina B6 (piridoxina) o vitaminas del complejo B.
- En el caso de una neuropatía periférica establecida, debe administrarse piridoxina en una dosis más alta de 100-200 mg diarios. Véase también el capítulo 5 para más detalles sobre la piridoxina.
- Reacciones digestivas con la rifampicina (dolor abdominal, náuseas, vómitos): Si los síntomas son leves, el episodio suele regresar de manera espontánea y puede bastar con tranquilizar a la persona. Si la intolerancia digestiva es lo suficientemente grave como para arriesgar una interrupción del tratamiento, suspender la rifampicina por tres o cuatro dosis, utilizar medicamentos que proporcionen alivio sintomático (como la metoclopramida para contrarrestar el vómito) o como un último recurso administrar rifampicina con cantidades pequeñas de alimentos para permitir el uso continuo del medicamento. Aunque la ingestión concomitante de alimentos reduce ligeramente la absorción de la rifampicina, esto es preferible a la interrupción total de la rifampicina.
- Letargia: Tranquilizar a la persona.
- Coloración anormal de las secreciones corporales (orina, lágrimas, semen y sudor) roja o anaranjada: tranquilizar a la persona.
B. Isoniacida y rifapentina
Tenga presente que las rifamicinas son potentes inductores enzimáticos y todo efecto secundario debe evaluarse y tratarse junto con las posibles interacciones medicamentosas (véase adelante, en este capítulo).
C. Supervisión sistemática: debería incluir la tolerabilidad y la adhesión. Busque los siguientes elementos en cada contacto con la persona que recibe el TPT:
- Signos o síntomas de TB (“intercurrente” o diagnóstico pasado por alto al comienzo del TPT)
- Embarazo: discontinuar el 3HP, considerar otra opción de TPT (por ejemplo, DFC de isoniacida + vit. B6 + CPT).
- Evento adverso: tipo, inicio y duración, gravedad.
- Evaluar la adhesión y prestar el apoyo necesario: toda interrupción del tratamiento se debe abordar con la persona que lo recibe y con la persona que apoya el tratamiento y se deben instituir intervenciones que solucionen los problemas de adhesión.
- Otras enfermedades como la malaria.
- Exploración física pertinente.
- Verificar la toma de cualquier medicamento (incluidas los remedios tradicionales) que pueda interactuar con el TPT.
- Pruebas de función hepática en las personas: que tenían concentraciones altas de base o en una consulta anterior o con antecedentes de consumo regular de alcohol. No están indicadas las pruebas sistemáticas de función hepática cuando se administra el TPT durante el embarazo, a menos que existan otros riesgos de hepatotoxicidad.
Punto clave: Las pruebas de la función hepática antes de iniciar el TPT no están indicadas de manera sistemática. Estas pruebas iniciales y de seguimiento solo se necesitan cuando existe un riesgo definido como una disfunción hepática preexistente, cirrosis hepática u otras indicaciones.
Los programas nacionales deberían establecer un mecanismo de registro sistemático de todo evento adverso notificado por las personas que reciben TPT. Además del tratamiento inmediato, también deben notificarse las reacciones adversas presuntas o confirmadas a las autoridades nacionales responsables de la farmacovigilancia, en conformidad con las reglamentaciones locales. Se debe emprender un examen periódico de los archivos de los casos, con el fin de evaluar los tipos más frecuentes de eventos adversos y ajustar la ejecución de los programas con miras a reducirlos al mínimo.
Interacciones medicamentosas
Rifamicinas y ARV
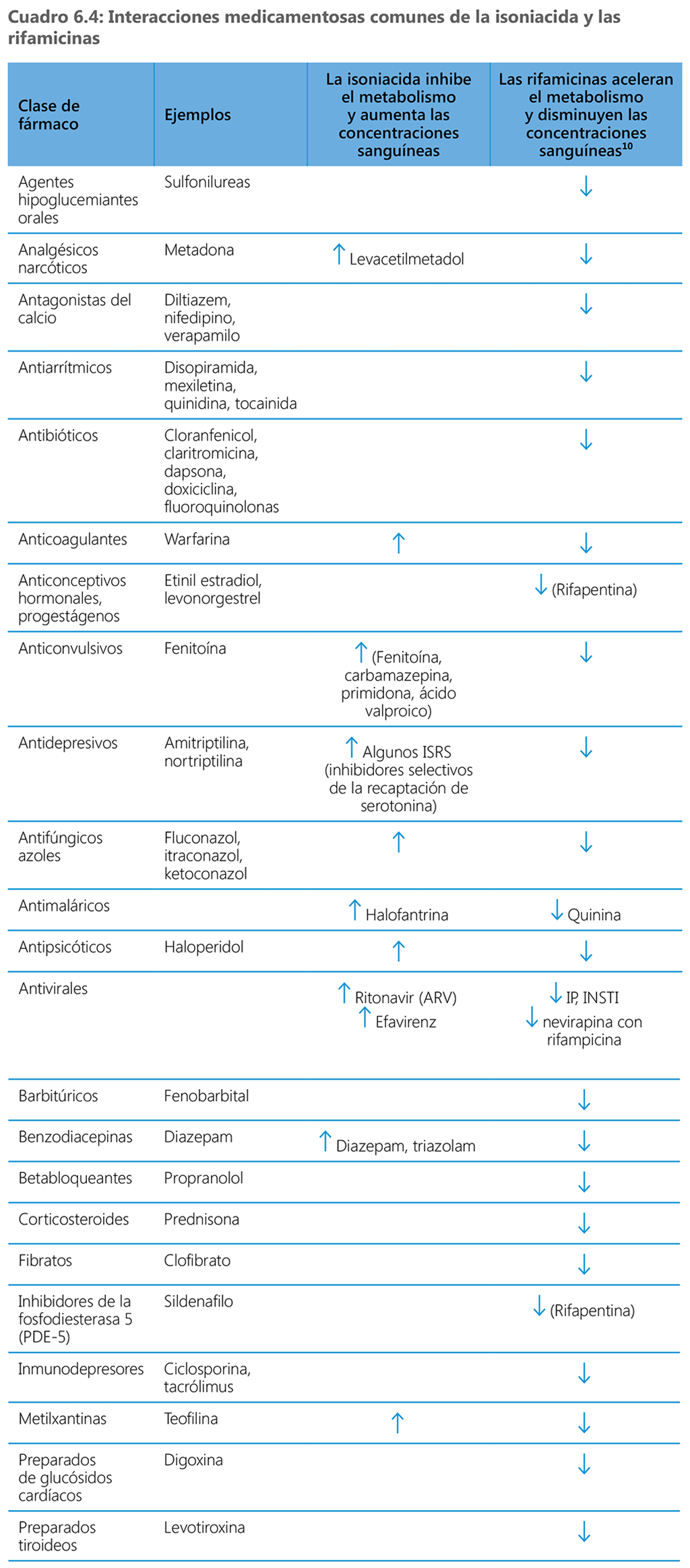
Cuando las rifamicinas y los ARV se administran juntos, se puede modificar el efecto de alguno de los medicamentos en el organismo. Una interacción medicamentosa puede aumentar o reducir la acción, o disminuir la eficacia de uno o ambos medicamentos o causar eventos adversos. Las rifamicinas son inductores potentes del metabolismo de las enzimas, incluidas las del citocromo P450 y, por consiguiente, pueden interferir con los medicamentos que dependen de esta vía metabólica, acelerando su eliminación. La rifampicina, en especial, es un inductor potente de las enzimas hepáticas CYP 450 (sobre todo de las subfamilias 3A y 2C), la glucoproteína P y la uridinadifosfato-glucuroniltransferasa (UGT) 1A. Asimismo, la rifapentina induce las enzimas P450, en concreto las isoenzimas CYP3A4, CYP2C8 y CYP2C9 (105). La rifampicina y la rifapentina tienen una potencia de inducción equivalente, pero la rifabutina es un inductor menos potente. En consecuencia, las rifamicinas aceleran el metabolismo de muchos medicamentos complementarios, incluidos algunos medicamentos ARV. Por lo tanto, la administración concomitante de estos ARV con las rifamicinas puede causar una disminución de la biodisponibilidad del ARV y aumentar el riesgo de fracaso del tratamiento contra el VIH o de aparición de resistencia. Los ARV más afectados por la inducción del CYP 450 causada por la rifamicina incluyen todos los inhibidores de la proteasa (IP), los inhibidores no nucleosídicos de la retrotranscriptasa (NNRTI), los inhibidores de transferencia de hebras de la integrasa (INSTI) (como el dolutegravir) y los antagonistas de CCR5 (como el maraviroc). Las rifamicinas también interactúan con muchos otros medicamentos que se resumen en el cuadro 6.4. Por consiguiente, cuando estos medicamentos se administran concomitantemente con el TPT a base de rifamicina, es preciso contar con un juicio clínico sólido, ya sea para evitar estos esquemas o ajustar la dosis de otros medicamentos administrados de manera concomitante (106).
En general, se debe tener cuidado cuando se recetan los esquemas que contienen rifampicina y rifapentina a las personas con infección por el VIH que reciben TAR. Estos esquemas no se deben administrar a las personas con infección por el VIH que reciben IP o esquemas a base de nevirapina. Si bien no es necesario ajustar la posología cuando se administra la rifampicina con el efavirenz, la dosis de dolutegravir debe aumentarse a 50 mg dos veces al día en los adultos, cuando se administra conjuntamente con rifampicina (107). Esta posología se tolera bien y ofrece una eficacia equivalente en la supresión del virus y la recuperación de las cifras de células CD4, en comparación con el efavirenz (108). El 3HP se puede administrar a las personas que reciben esquemas ARV a base de efavirenz, sin necesidad de ajustar la posología (109). La administración de rifapentina con raltegravir también es segura y bien tolerada (110).
Administración concomitante de rifapentina y dolutegravir
Aunque se sabe que la rifapentina una vez por semana disminuye la exposición a dolutegravir, la concentración sanguínea de dolutegravir permanece por encima de las concentraciones teóricas que se asocian con la supresión viral en los adultos que reciben ambos medicamentos. Un estudio demostró que es poco probable que una disminución de la concentración de dolutegravir, incluso hasta 75%-80%, tenga una repercusión con significación clínica, ya que incluso una dosis de 10 mg de dolutegravir una vez al día ( junto con una base de inhibidores nucleosídicos de la retrotranscriptasa [NRTI]) produce tasas altas de supresión del virus por 96 semanas, equivalente al esquema que contiene efavirenz (111). Por consiguiente, el dolutegravir puede administrarse semanalmente con la rifapentina sin ninguna modificación de posología.
También se ha demostrado que la administración concomitante de estos medicamentos es en general segura. Los ensayos de fase I y II del esquema de 3HP y dolutegravir en adultos con infección por el VIH y con supresión de la carga viral comunicaron una tolerabilidad adecuada y mantenimiento de la supresión del virus. No se comunicaron eventos adversos de grado 3 y los resultados indicaron que no había necesidad de ajustar la dosis de dolutegravir en adultos con infección por el VIH que reciben TAR a base de dolutegravir (112).
Sin embargo, se necesitan más estudios sobre la farmacocinética del esquema de 3HP en administración concomitante con otros medicamentos, en especial los IP potenciados y la alafenamida de tenofovir, y que incluyan tanto a embarazadas como a niños. Están en curso algunos estudios que evalúan las concentraciones de dolutegravir con rifapentina diaria y la necesidad de ajustar la dosis de dolutegravir con 1HP en los adultos y los niños (ACTG 5372).
Opciones de ARV en administración concomitante con el TPT a base de rifamicina
El cambio de TAR para adaptarlo a un determinado esquema de TPT debe hacerse con la máxima precaución. El médico debe sopesar con cuidado los riesgos frente a los beneficios de este cambio, ya que la modificación frecuente del TAR se asocia con pérdida del control virológico y, por lo tanto, debe evitarse en la medida de lo posible, sobre todo cuando la persona ha suprimido la carga viral con el TAR en curso. Además, no es ideal cambiar el TAR a base de efavirenz en muchas zonas con tasas altas de resistencia a los NNRTI (incluidas muchas regiones en África subsahariana). En general, un TAR exitoso debería tener primacía en la decisión sobre la elección del esquema de TPT. Las siguientes opciones existen si se considera la posibilidad de cambiar el TAR para un uso compatible con el TPT que contiene rifamicina
- La mayoría de los INSTI y los inhibidores de la fusión no tienen interacciones medicamentosas importantes con las rifamicinas.
- Los datos farmacocinéticos no revelan interacciones medicamentosas notables de la rifapentina con el NNRTI efavirenz (113‒115) y el INSTI raltegravir (110).
- No se han informado interacciones medicamentosas notables con el uso de rifapentina y TAR que contienen abacavir (ABC), emtricitabina (FTC), fumarato de disoproxilo de tenofovir (TDF), lamivudina (3TC) o zidovudina (AZT). Los esquemas a base de efavirenz o raltegravir utilizados en combinación con ABC/3TC o TDF/FTC pueden administrarse con 3HP.
La alafenamida de tenofovir es una excepción notable, dado que el hecho de ser sustrato de la glucoproteína P puede dar lugar a una exposición inaceptablemente baja al fármaco, por causa de una rifamicina como la rifapentina. Por consiguiente, debe evitarse la administración concomitante de alafenamida de tenofovir y una rifapentina hasta que se disponga de más datos que respalden su utilización concomitante (116). Cabe señalar que la alafenamida de tenofovir administrada con rifampicina produce niveles intracelulares del fármaco activo, difosfato de tenofovir (TDF-DP), equivalentes a los del TDF administrado solo, lo que indica que esta combinación podría utilizarse conjuntamente, pero los datos clínicos son limitados (117).
Isoniacida
Se sabe que la isoniacida inhibe algunas enzimas del citocromo P-450. La administración concomitante de isoniacida con fármacos que siguen una biotransformación en estas vías metabólicas puede disminuir su eliminación y con ello aumentar las concentraciones o la exposición al fármaco. En consecuencia, la posología de los medicamentos metabolizados por estas enzimas puede necesitar un ajuste cuando se inician o se interrumpen de manera simultánea, con el fin de mantener concentraciones sanguíneas terapéuticas óptimas. Se ha informado que la isoniacida inhibe el metabolismo de los siguientes fármacos: efavirenz, anticonvulsivos, benzodiacepinas, haloperidol, ketoconazol, teofilina y warfarina. Se desconocen los efectos concurrentes de la rifampicina y la isoniacida sobre el metabolismo de estos fármacos, pero los efectos inductores de la rifampicina tienden a ser más prominentes. En el cuadro 6.4 se resumen las interacciones medicamentosas similares de las rifamicinas.
Puntos clave
- La administración concomitante de los ARV usados comúnmente y el TPT es segura y existen opciones disponibles cuando se sospecha una exposición baja a los ARV debido a una interacción medicamentosa.
- Hay que tener cuidado cuando una persona que recibe TPT también está en tratamiento por alguna comorbilidad.
- Las mujeres que toman anticonceptivos hormonales deben usar además un método anticonceptivo de barrera para evitar el embarazo cuando utilizan TPT a base de rifamicina.
TPT a base de rifamicina y tratamiento contra la malaria
La rifampicina y otras rifamicinas, al ser potentes inductores de CYP3A4, disminuyen la exposición a la quinina en los adultos que reciben tratamiento contra la malaria, lo cual quintuplica la tasa de recrudecimiento (64). Asimismo, la administración concomitante con mefloquina causa una triple disminución de la exposición a la mefloquina. Se han informado disminuciones equivalentes del grado de exposición con la administración concomitante de rifampicina y arteméter y de dihidroartemisinina y lumefantrina (una disminución de 9, 6 y 3 veces, respectivamente). No existe evidencia suficiente para modificar las recomendaciones vigentes de posología en mg/kg de peso corporal de estos fármacos contra la malaria, por lo que la supervisión estrecha debe tener en cuenta el riesgo del aumento de recrudecimientos. La siguiente orientación se puede aplicar hasta que se disponga de evidencia clara sobre las formas de aumentar la exposición a los fármacos antimaláricos:
- Si a una persona se le diagnostica malaria, pero todavía no está recibiendo un TPT que contenga rifamicina, se debe dar prioridad al episodio de malaria y tratarlo primero.
- Si a una persona se le diagnostica malaria mientras recibe un TPT a base de rifamicina, el tratamiento de la malaria debe iniciarse de forma concomitante y con supervisión clínica en consonancia con las directrices nacionales, a fin de garantizar la curación de la malaria. La evidencia es insuficiente para indicar la necesidad de ajustar las dosis del TPT o del TCA (tratamiento combinado con artemisinina).
- Si una persona presenta una recaída de malaria mientras recibe TPT, debe tratarse de nuevo contra la malaria según las directrices nacionales. El tratamiento preventivo solo debe suspenderse cuando el nuevo tratamiento antimalárico incluye también fármacos con interacciones conocidas con las rifamicinas. El TPT puede reanudarse una vez que se haya resuelto el episodio de malaria.
- Si una persona cumple los criterios diagnósticos de malaria grave (pérdida de conciencia, hipoglucemia, bilirrubina alta o ictericia, hemorragia, anemia, insuficiencia renal y parasitemia >10%) es necesario suspender el TPT y tratarla de urgencia según las directrices nacionales. El TPT debería reanudarse solo cuando el episodio de malaria se haya resuelto por completo.
¿Cuánto dura la protección que ofrece un ciclo de TPT?
La duración de la protección contra la TB depende tanto de la potencia del esquema de TPT para esterilizar la infección por TB, como del riesgo de reinfección después del tratamiento. La infección por TB que no se trata adecuadamente debido a un esquema menos potente o a una adhesión deficiente al tratamiento puede dar lugar a una reactivación de la infección por TB que progrese hacia la TB activa.
Las personas con infección por el VIH corren un gran riesgo de reactivación de la infección por TB y también de progresión hacia la TB activa una vez que contraen la infección. En la época anterior al TAR, varios estudios determinaron que el riesgo creciente de contraer la TB después de un ciclo de TPT en los países con carga alta; y, por el contrario, se observaba una protección más duradera en los países con carga mediana o baja, con respecto a la reducción de la mortalidad y la incidencia de TB. Sin embargo, algunos ensayos recientes realizados en una época de acceso en gran escala al TAR, sugieren que la protección que ofrece el TPT, incluso en entornos con carga alta, puede durar tanto tiempo como en los ámbitos con una carga de TB mediana o baja.
- En Côte d’Ivoire, donde la última incidencia de TB notificada fue de 159 por 100 000 habitantes, seis meses de TPI tuvieron un fuerte efecto protector y redujeron la mortalidad de las personas con la infección por el VIH que habían comenzado TAR, incluso cuando las cifras de células CD4 eran altas y el efecto protector duró hasta seis años (118).
- En Brasil (prevalencia mediana de TB), el TPI redujo de manera significativa el riesgo de presentar TB activa en los pacientes con la infección por el VIH con una PT positiva. Un ciclo de seis meses de isoniacida redujo el riesgo de TB durante más de siete años, a diferencia de los resultados de estudios en entornos con carga alta en África, donde la incidencia de TB aumentó inmediatamente después del TPI (119,120).
- Estudios recientes en Myanmar e Indonesia (carga alta de TB) reafirmaron la duración de la protección con seis meses de TPI en las personas con infección por el VIH. En Myanmar, completar un ciclo de TPI disminuyó de manera significativa el riesgo de TB y de muerte hasta durante ocho años. En Indonesia el beneficio protector duró más de cinco años (121,122).
- En el ensayo BRIEF-TB (97% de los participantes eran de países con carga alta de TB), la incidencia de TB después de un ciclo completo de TPT, ya sea con un esquema de isoniacida y rifapentina durante un mes o un esquema de isoniacida durante nueve meses, permaneció estable durante todo el período de seguimiento de tres años del ensayo clínico. Casi todas las personas con infección por el VIH en este estudio recibían TAR (54). En los contactos del hogar de pacientes con TB que recibían TPT en la época anterior al VIH, se demostró que el TPI ofrecía un beneficio duradero incluso en los entornos con tasas muy altas de TB.
- Los Servicios de Salud Pública de Estados Unidos patrocinaron varios estudios para evaluar la eficacia del TPI en el decenio de 1960. En Alaska, se estudió un grupo grande de personas con riesgo de contraer la TB debido al contacto reciente o remoto con un paciente con TB pulmonar (123). En 1958, se informó que 2% de la población en esta zona tenía TB y una encuesta tuberculínica reveló una tasa anual promedio de infección por TB de 8%. Estos niveles se encontraban entre los más altos jamás notificados, incluso superiores a los de entornos con la transmisión más alta como las minas de Sudáfrica, cuya incidencia estimada fue de 4,2% en el 2005 (124). Los participantes recibieron isoniacida 300 mg al día o 5 mg/kg en los niños o un placebo correspondiente durante un año. Se llevó a cabo un seguimiento activo de dos años y una notificación pasiva durante los diez años siguientes. Los datos de seguimiento de un estudio de 28 pueblos y dos internados en Alaska que comenzaron en 1958, mostraron que el efecto protector de la isoniacida persistió hasta durante 19 años (125). El cálculo de que seis a nueve meses de tratamiento preventivo era óptimo se derivó de los datos de seguimiento de este estudio y de un estudio de la Unión Internacional contra la Tuberculosis y las Enfermedades Respiratorias, en el cual se encontró que la isoniacida administrada durante más de nueve meses no mejora la eficacia (69,126).
- Una revisión sistemática publicada en 1999 (127) reafirmó la eficacia de la isoniacida en la prevención de la aparición de TB activa en cerca de 60% de personas en diferentes grupos vulnerables, incluidos los contactos del hogar. Por cada 35 contactos domésticos recientes con una PT positiva en quienes se recetó isoniacida durante seis meses, se previno un caso de TB en los cinco años siguientes.
¿Cuándo es necesario repetir o reiniciar el TPT?
Hasta la fecha, no existe evidencia sobre la utilidad de ciclos repetidos de TPT. Por consiguiente, las directrices de la OMS del 2020 sobre el TPT no recomiendan específicamente un ciclo repetido de TPT. Sin embargo, en entornos con transmisión alta de TB (de conformidad con lo definido por las autoridades locales), se recomienda el uso de isoniacida durante 36 meses (como un sustituto del tratamiento de por vida) en las personas con infección por el VIH (véase la recomendación abajo). Una de las esferas prioritarias de investigación en estos entornos es evaluar si es necesario repetir los ciclos de los esquemas acortados y, en caso afirmativo, con qué frecuencia.
Recomendación de la OMS:
18. En los entornos con transmisión alta de TB, los adultos y adolescentes con infección por el VIH que tengan una prueba de ILTB desconocida o positiva y poca probabilidad de tener una TB activa, deberían recibir al menos 36 meses de tratamiento preventivo con isoniacida diaria (TPI). El TPI diario durante 36 meses se debe administrar, independientemente de que la persona reciba o no TAR y del grado de inmunodepresión, los antecedentes de tratamiento contra la TB y el embarazo, en los entornos considerados de transmisión alta de TB, según lo definido por las autoridades nacionales.
Un ensayo clínico pragmático aleatorizado (WHIP3TB) de personas con infección por el VIH que recibían TAR en Etiopía, Mozambique y Sudáfrica, completado a fines del 2019, comparó la eficacia del esquema de 3HP administrado una vez (n = 1802) o dos veces en 14 meses (n = 1808), con un ciclo de 6H (n = 404). La tasa de finalización del tratamiento fue mejor con 3HP que con 6H. El seguimiento durante 24 meses después de la aleatorización mostró las tasas equivalentes de incidencia de TB, incidencia de TB resistente a la rifampicina y de mortalidad en los participantes que recibían 3HP una vez o dos veces, lo cual indica que el 3HP en las personas con infección por el VIH que reciben TAR, en entornos de transmisión alta de la TB ofrece protección y que repetirlo anualmente no aumenta los beneficios (128). El seguimiento a más largo plazo de este estudio será importante para comprender la duración del efecto.
Sin embargo, debe considerarse la posibilidad de repetir el ciclo de TPT en las personas seropositivas o seronegativas al VIH que completaron un ciclo anterior, pero que luego han sido contactos del hogar o contactos estrechos de un paciente con TB. Dado que las pruebas disponibles en la actualidad (PT e IGRA) no se hacen negativas después de un ciclo completo de TPT, estas no pueden usarse para evaluar los criterios de aptitud a la repetición del ciclo si ocurre una nueva exposición o reinfección. Por consiguiente, la evaluación cuidadosa de la intensidad de la exposición y el balance entre los beneficios y los daños debería orientar la decisión de administrar un ciclo repetido de TPT.
Puede ser necesario reiniciar el TPT si hubo una interrupción importante del tratamiento administrado. En el capítulo 5 (cuadro 5.3) y el capítulo 7 (cuadro 7.1) se proponen algunos umbrales para determinar la pérdida durante el seguimiento con diferentes esquemas, según los criterios aplicados en los ensayos. Esta es otra esfera en la que falta evidencia fiable sobre la “permisividad” de los esquemas a la interrupción.
¿El TPT causa farmacorresistencia?
Una de las preocupaciones planteadas históricamente sobre el uso del TPT en gran escala es el riesgo eventual de propagación de la farmacorresistencia. Estas inquietudes no han sido respaldadas por la evidencia hasta la fecha (58). En muchos estudios no se ha logrado encontrar pruebas científicas de una asociación significativa entre la farmacorresistencia de la TB y el uso de isoniacida o rifamicina en el TPT (129,130). Preocupaciones como estas, en realidad, han privado a innumerables grupos del beneficio de una intervención que puede salvar vidas. La mayor parte de la farmacorresistencia surge de un tratamiento inadecuado de la TB. Es poco probable que se produzca un aumento de resistencia a los medicamentos si se observan prácticas adecuadas de TPT en los programas, a saber, que el TPT se administre a las personas sin TB. Las personas con infección por TB albergan en el organismo un número reducido de bacterias de crecimiento lento y, por lo tanto, el riesgo es bajo de que el TPT seleccione cepas farmacorresistentes (129). Por el contrario, el TPT puede disminuir la carga global de TB activa y con ello, reducir el número de personas que podrían recibir un tratamiento inadecuado contra la TB, que favorece la aparición y la propagación de TB-MDR.
Antes de iniciar el TPT es necesario descartar la TB activa utilizando las herramientas disponibles y llevar a cabo un seguimiento periódico con el fin de garantizar la adhesión al TPT y el reconocimiento temprano de los síntomas de TB mientras dura el tratamiento. También se puede reforzar la vigilancia de la farmacorresistencia en las personas que contraen una TB confirmada microbiológicamente durante el TPT o después del mismo.
Punto clave: La creencia común de que el uso del TPT en gran escala alimentará la farmacorresistencia no está respaldada por la evidencia y representa el tipo de obstáculos que impiden que los grupos vulnerables accedan a las intervenciones que pueden protegerlos y proteger a sus comunidades de la enfermedad y la muerte por TB que se pueden evitar
Resistencia a la isoniacida después del TPI
En una revisión sistemática de 13 estudios publicados desde 1951, que incluyeron 18 095 personas que recibían el TPI y 17 985 testigos, no hubo ningún indicio de un mayor riesgo de TB resistente a la isoniacida después del TPI; los resultados fueron similares cuando se estratificaron con respecto al VIH (129). Además, en el estudio de cohortes de Thibela en Sudáfrica, las proporciones de episodios de TB con farmacorresistencia en pacientes que habían recibido TPI no fueron significativamente diferentes de las proporciones en los grupos de referencia (131).
Resistencia a la rifamicina después del TPT
En un análisis de seis ECA sobre esquemas de TPT que contienen rifamicina comparados con testigos activos o placebo, se demostró que la incidencia de casos resistentes a la rifampicina fue 0,09% en 6808 personas que recibían un TPT a base de rifamicina, contra 0,01% en 7415 personas que recibían otros esquemas (RR: 3,45; IC 95%: 0,72-16,56; p = 0,12) (130). En tres de estos estudios que utilizaban un TPT intermitente a base de rifamicina, hubo dos casos de resistencia a la rifampicina entre 4673 personas con el esquema intermitente que contenía rifamicina, en comparación con un caso con resistencia a la rifampicina entre 4427 personas que recibían los esquemas testigo (RR: 3,89; IC 95%: 0,44-34,56; p = 0,22). En los estudios comparativos con placebo, no hubo ningún caso de resistencia a la rifampicina en los participantes que recibían esquemas que contenían rifamicina, pero se presentaron varios casos en los participantes que recibían placebo (RR: 0,20; IC 95%: 0,02-1,66) (130).
 Reacción
Reacción