Enlaces transversales de Book para 1.2 Summary of evidence
En esta sección se presentan las preguntas PICO planteadas, los datos y estudios considerados para responder a las preguntas, los métodos utilizados para el análisis y la síntesis de datos, un resumen de la evidencia sobre los efectos deseables e indeseables y el grado de certeza en la evidencia, así como un resumen de la evidencia de otro tipo considerada durante la elaboración de la recomendación. En los anexos en la web que contienen los cuadros con el resumen de la evidencia según el método GRADE (anexo 3 en la web) y los cuadros para pasar de los datos a las decisiones según el método GRADE (anexo 4 en la web) se ofrece información adicional sobre la evidencia.
Preguntas PICO
La recomendación de esta sección es el resultado de las evaluaciones de las preguntas PICO que se enumeran a continuación. Debido a los diferentes grupos de intervención y de comparación utilizados, las preguntas PICO 3, 5 y 6 se han dividido en varias subpreguntas PICO (se proporciona información detallada en el texto y en el cuadro1.3).
Pregunta PICO 3 2022 (TB-RR/MDR, 2022): ¿Se deben utilizar esquemas de BPaL con menor exposición al linezolid (dosis o duración) en lugar del esquema de BPaL original en pacientes que cumplen los requisitos para el esquema de BPaL?
Pregunta PICO 4 2022 (TB-RR/MDR, 2022): ¿Se debe utilizar un esquema de 6 meses con bedaquilina, pretomanid y linezolid en pacientes con TB-pre-XDR (TB-RR/MDR con resistencia a las fluoroquinolonas) pulmonar?
Pregunta PICO 5 2022 (TB-RR/MDR, 2022): ¿Se debe utilizar un esquema de 6 meses con bedaquilina, pretomanid y linezolid en pacientes con TB-RR/MDR pulmonar y sin resistencia a las fluoroquinolonas?
Pregunta PICO 6 2022 (TB-RR/MDR, 2022): ¿Se debe utilizar un esquema de 6 meses con bedaquilina, pretomanid y linezolid con o sin adición de moxifloxacina (BPaLM) o clofazimina en pacientes con TB-RR/MDR pulmonar (con o sin resistencia a las fluoroquinolonas)?
Datos y estudios considerados
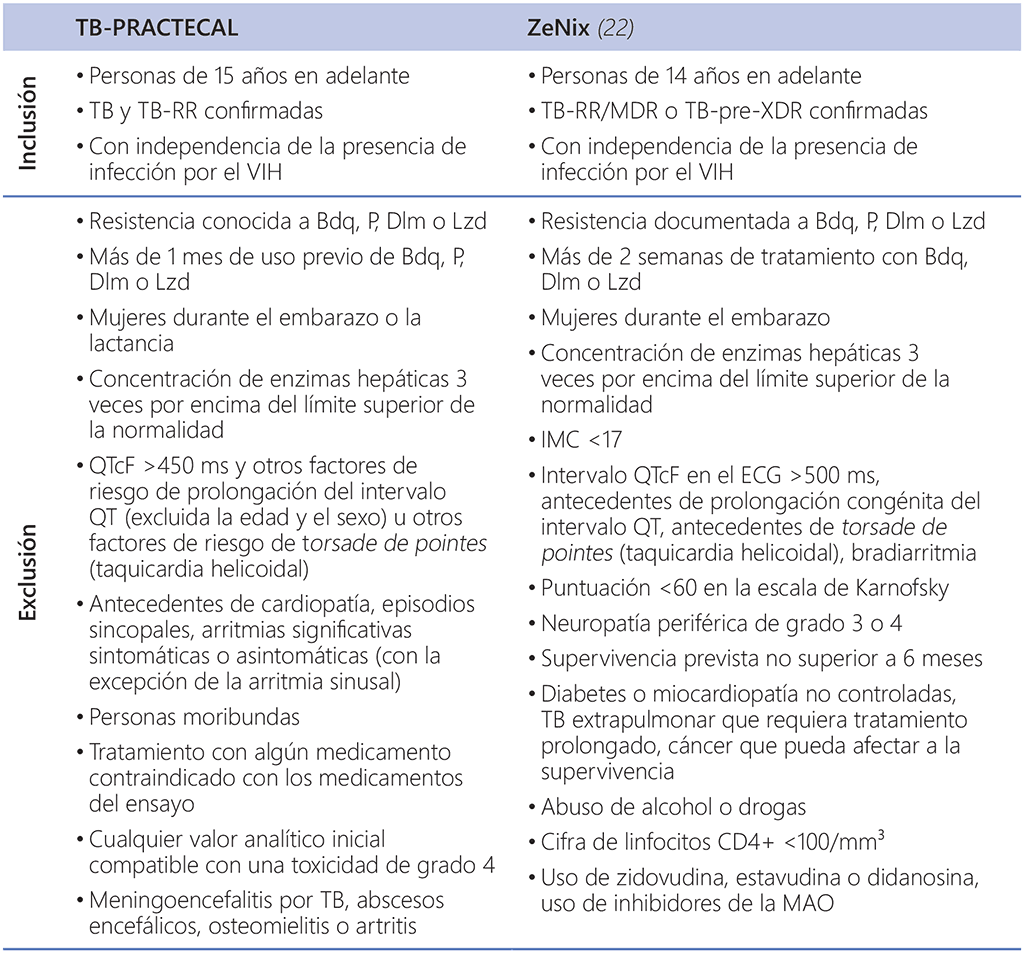
El examen de este grupo de preguntas PICO durante la reunión del grupo de elaboración de las directrices convocada por la OMS en febrero y marzo del 2022 se basó en la nueva evidencia aportada por Médicos Sin Fronteras a partir del ensayo clínico TB-PRACTECAL y por TB Alliance a partir del ensayo ZeNix. Para varias evaluaciones en el marco de esta pregunta PICO, se utilizaron los datos del conjunto de datos de pacientes individuales de la OMS del 2021. Las poblaciones de pacientes incluidas en dos ensayos se seleccionaron siguiendo estrictos criterios de inclusión y exclusión; las poblaciones presentaban muchas similitudes y pocas diferencias notables. Los aspectos más destacados de los criterios utilizados en estos ensayos se presentan en el cuadro 1.1. La lista completa de los criterios de exclusión se puede consultar en el anexo 2 y en los protocolos de ensayo publicados.¹⁴
Cuadro 1.1. Resumen de alto nivel de los principales criterios de inclusión y exclusión: ensayos TB-PRACTECAL y ZeNix (listas completas en el anexo 2)
TB-PRACTECAL
El estudio TB-PRACTECAL fue un ensayo de fase II-III multicéntrico, aleatorizado, comparativo, sin enmascaramiento, con varios grupos y etapas, en el que se evaluaron esquemas de tratamiento acortados que contenían bedaquilina y pretomanid en combinación con fármacos contra la TB existentes y reposicionados (por ejemplo, el linezolid y la clofazimina) para el tratamiento de la TB-RR/ MDR pulmonar confirmada microbiológicamente.¹⁵
El estudio se dividió en dos etapas, con una transición fluida entre ellas, lo que significa que la inclusión en un grupo únicamente se detendría después de haber tomado una decisión tras el análisis de los datos del criterio principal de valoración de la etapa 1. En la primera etapa —equivalente a un ensayo de fase IIB de seguridad y de eficacia preliminar— se asignó aleatoriamente a los pacientes a uno de cuatro esquemas, estratificados por centro. Los esquemas en investigación incluían la bedaquilina, el pretomanid y el linezolid por vía oral. Dos de los esquemas también incluían la moxifloxacina (grupo 1) y la clofazimina (grupo 2). El objetivo principal de la etapa 1 era seleccionar esquemas farmacológicos para su evaluación en la etapa 2, basándose en criterios de valoración de la seguridad y la eficacia a las 8 semanas. En evaluaciones posteriores no se tuvo en cuenta a los grupos en investigación que no alcanzaron los criterios predefinidos de seguridad y eficacia.
La segunda etapa del estudio equivalía a un ensayo de fase III en el que se investigó la seguridad y la eficacia del esquema más prometedor. A las 72 semanas de la aleatorización, según lo previsto en el protocolo del estudio, se evaluaron la seguridad y la eficacia del esquema en comparación con el grupo del tratamiento de referencia. En la etapa 2 del ensayo se incluyó un grupo de intervención con BPaLM que se comparó con el tratamiento de referencia aprobado localmente, de conformidad con las recomendaciones de la OMS para el tratamiento de la TB-RR/MDR o de la TB-pre-XDR en el momento en que se realizó el ensayo (incluido un esquema de 9-12 meses que contenía medicamentos inyectables; un esquema de 18-24 meses recomendado por la OMS [anterior al 2019]; un esquema de tratamiento totalmente oral de 9-12 meses; y un esquema de tratamiento totalmente oral de 18-20 meses). En el ensayo TB-PRACTECAL se dejó de inscribir a pacientes poco después de que su comité independiente de seguridad y seguimiento de datos indicara que el esquema de BPaLM era superior al tratamiento de referencia, porque se consideró que era extremadamente improbable que más datos cambiaran los resultados del ensayo. Este ensayo no se diseñó para comparar los esquemas en investigación entre sí.
Los pacientes que cumplían los requisitos para participar en el estudio tenían de 15 años en adelante, presentaban una TB confirmada bacteriológicamente (mediante pruebas moleculares o fenotípicas) y resistencia al menos a la rifampicina, determinada mediante una prueba molecular o fenotípica de sensibilidad a fármacos. El criterio principal de valoración de la eficacia fue la variable compuesta de resultados desfavorables (fracaso del tratamiento, muerte, retirada del tratamiento, recaída o pérdida de contacto durante el seguimiento) 72 semanas después de la aleatorización. Entre los criterios secundarios de valoración de la eficacia relevantes se encontraban la conversión del cultivo a las 12 y 24 semanas, resultados desfavorables 24 semanas después de la aleatorización, resultados desfavorables 108 semanas después de la aleatorización, la mediana del tiempo transcurrido hasta la conversión del cultivo y la recaída en la semana 48 en los grupos en investigación. Se asignó aleatoriamente a los participantes, en una proporción de 1:1:1:1, al tratamiento de referencia o a alguno de estos tres grupos de intervención:
- grupo 1: 24 semanas de B-Pa-Lzd-Mfx (BPaLM);
- grupo 2: 24 semanas de B-Pa-Lzd-Cfz (BPaLC); y
- grupo 3: 24 semanas de B-Pa-Lzd (BPaL).
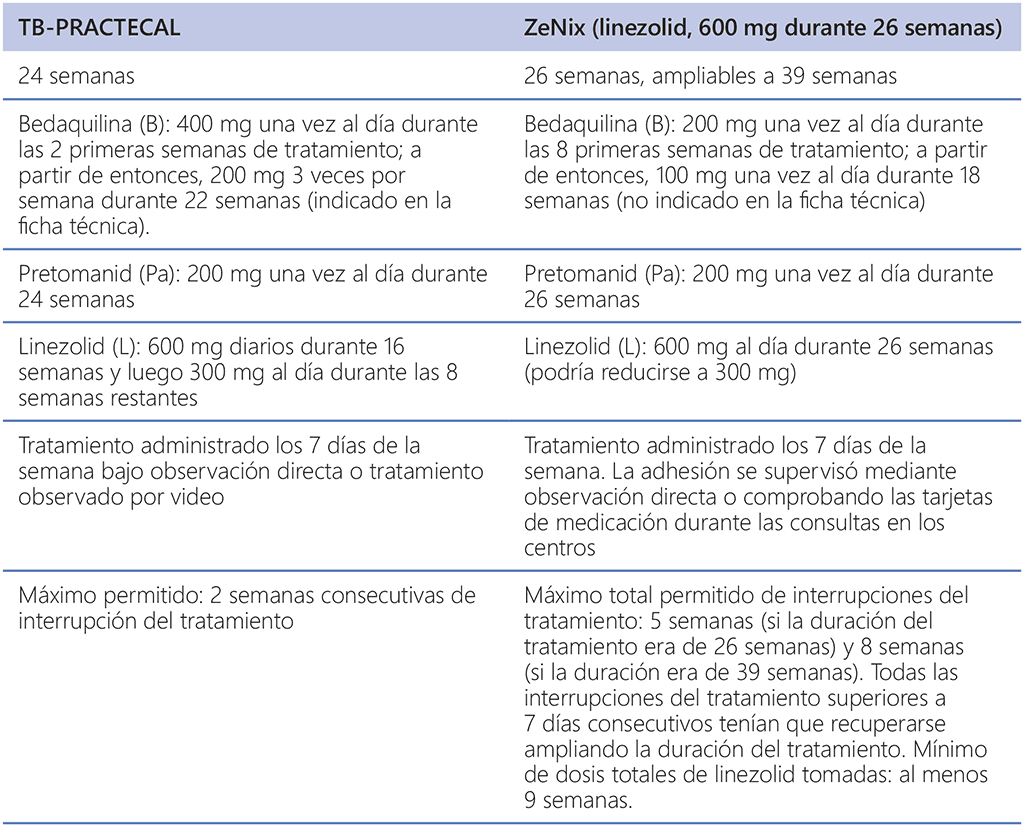
En todos los grupos de intervención, el linezolid se administró en dosis de 600 mg al día durante 16 semanas, y a partir de entonces en dosis de 300 mg al día durante las 8 semanas restantes (o antes en caso de tolerabilidad moderada). La bedaquilina se administró en dosis de 400 mg una vez al día durante 2 semanas, y a partir de entonces en dosis de 200 mg 3 veces por semana durante 22 semanas. En la mayoría de los participantes, el seguimiento de la seguridad incluyó la realización de múltiples electrocardiogramas (ECG): al inicio del estudio, luego semanalmente hasta la semana 8, posteriormente cada 4 semanas hasta la semana 24, y desde entonces cada 8 semanas. El seguimiento microbiológico incluyó la baciloscopia y el cultivo al inicio y el día 7, luego cada 4 semanas hasta la semana 24 y posteriormente cada 8 semanas.
ZeNix
El estudio ZeNix fue un ensayo de fase III aleatorizado, con enmascaramiento parcial, en el que se evaluó la seguridad y la eficacia de varias dosis y duraciones del tratamiento con linezolid más bedaquilina y pretomanid en personas con TB-RR/MDR pulmonar y resistencia adicional a las fluoroquinolonas (con o sin resistencia a medicamentos inyectables) o en personas con TB-RR/MDR que no toleraran el tratamiento o no respondieran al mismo. Para participar, los pacientes debían tener 14 años o más, pesar al menos 35 kg, tener un resultado confirmado de infección por el VIH y una TB-XDR confirmada bacteriológicamente mediante un cultivo de esputo (definición anterior al 2021) o una TB-RR/MDR confirmada bacteriológicamente, además de no haber tolerado o no haber respondido al tratamiento anterior contra la TB-RR/MDR. El criterio principal de valoración del estudio fue la incidencia de fracaso bacteriológico, recaída o fracaso clínico durante el seguimiento, de hasta 26 semanas después de finalizar el tratamiento. Entre los criterios secundarios de valoración se encontraban la incidencia de fracaso bacteriológico o recaída o fracaso clínico durante el seguimiento hasta 78 semanas después de finalizar el tratamiento. Los participantes recibieron tratamiento con BPaL durante 26 semanas. La dosis y la duración del tratamiento con linezolid variaron en cada uno de los cuatro grupos: 1200 mg durante 26 semanas, 1200 mg durante 9 semanas, 600 mg durante 26 semanas o 600 mg durante 9 semanas. La bedaquilina se administró en dosis de 200 mg una vez al día durante 8 semanas, y a partir de entonces en dosis de 100 mg una vez al día durante 18 semanas. Este esquema posológico, que no figura en la ficha técnica, está respaldado por simulaciones farmacocinéticas de un esquema posológico alternativo de bedaquilina que proporcionara exposiciones comparables, y se desarrolló para apoyar la adhesión terapéutica y facilitar la administración del tratamiento (administración diaria de todos los medicamentos durante todo el esquema) (23).
El seguimiento de la seguridad incluyó la realización programada de pruebas y evaluaciones de parámetros de laboratorio, ECG, constantes vitales y otras exploraciones físicas (24). El seguimiento microbiológico incluyó la baciloscopia, pruebas moleculares y el cultivo de esputo en medio líquido al inicio, y posteriormente el cultivo en medio líquido en todas las consultas de los pacientes (24).
Cuadro 1.2. Posología, administración del tratamiento y tolerancia respecto a las modificaciones del tratamiento relacionadas con la toxicidad

CONJUNTO DE DATOS DE PACIENTES INDIVIDUALES DE LA OMS (2021)
En el 2021, la OMS lanzó una convocatoria para la presentación de datos que sirvieran como grupo comparativo (grupo del tratamiento de referencia) con el cual comparar los esquemas de 6-9 meses de duración. Estas cohortes recibieron tratamiento con bedaquilina y linezolid durante un período de 6-24 meses, de conformidad con las directrices del 2020 de la OMS sobre la TB-DR. Se excluyó a los pacientes que recibían antibióticos inyectables.
Los conjuntos de datos incluidos estaban formados por personas que siguieron alguno de estos esquemas:
- esquemas totalmente orales de 6-12 meses de duración compuestos al menos por bedaquilina y linezolid; o
- un esquema totalmente oral de la OMS (2019) de 9-12 meses que contenía bedaquilina en la combinación 4-6 Bdq(6m)-Lfx/Mfx-Cfz-Z-E-Hh-Eto/5m Lfx/Mfx-Cfz-Z-E; o
- un esquema de tratamiento totalmente oral de la OMS (2018) de ≥18 meses que contenía al menos bedaquilina y linezolid
Los conjuntos de datos individuales incluidos en esta cohorte se describen detalladamente en el plan de análisis estadístico (anexo 6 en la web). Para poder incluir a los pacientes en un esquema acortado de comparación (meta: 9-12 meses al comenzar el tratamiento), los pacientes tenían que haber cumplido todos los requisitos que se indican a continuación:
- haber recibido tratamiento durante un período no superior a 12 meses;
- haber recibido seis o más fármacos durante el tratamiento, incluida la bedaquilina; y
- en caso de que el resultado fuera la curación o la finalización del tratamiento, que la duración del tratamiento hubiera sido de 8,5 meses o más.
Para poder incluir a los pacientes en un esquema alargado de comparación (meta: 18-24 meses), los pacientes tenían que haber cumplido cada uno de los siguientes requisitos:
- haber sido clasificados en el conjunto de datos como personas que habían recibido un esquema alargado (de haberse consignado);
- haber recibido el tratamiento durante no más de 24 meses;
- haber recibido cuatro o más fármacos (con independencia de la sensibilidad a los fármacos, es decir, independientemente de la probabilidad de que fueran eficaces), incluida la bedaquilina; y
- en caso de que el resultado fuera la curación o la finalización del tratamiento, que la duración del tratamiento hubiera sido de 17,5 meses o más.
Métodos usados para el análisis y para la síntesis de datos
Se realizaron análisis descriptivos de las características iniciales de los participantes en todos los estudios incluidos; estas características consistían en datos demográficos, resultados de pruebas diagnósticas, esquemas de tratamiento y resultados del tratamiento.
Se realizaron análisis comparativos dentro de cada estudio y entre varios estudios:
- Comparaciones dentro de cada estudio: en los estudios en que se utilizaron tanto un esquema acortado (6 meses de duración) como un tratamiento comparativo pertinente, se realizaron comparaciones por pares entre cada uno de los esquemas acortados y el esquema comparativo. En el caso de los ensayos clínicos aleatorizados incluidos (por ejemplo, el ensayo TB-PRACTECAL y el ensayo NExT), también se calculó y notificó el resultado principal del análisis preespecificado.
- Comparaciones por pares entre estudios: las comparaciones que abordaban cada pregunta PICO se realizaron comparando los resultados de distintas cohortes en las que los participantes recibieron la intervención o el esquema de referencia pertinente en cuanto a esa pregunta.
Modelos estadísticos
Para las comparaciones entre conjuntos de datos o cohortes, los resultados se presentaron como riesgos relativos (RR) ajustados y no ajustados. Los riesgos relativos ajustados (RRa) se calcularon mediante una regresión lineal generalizada logarítmico-binomial (distribución binomial de errores con función de enlace logarítmica). Los posibles factores de confusión preespecificados se ajustaron mediante ponderación por probabilidad inversa de índice de propensión. No surgieron problemas de convergencia con el modelo logarítmico-binomial. Cuando las tasas de resultados estaban cerca del límite, no se calcularon los RRa y se presentaron los RR no ajustados. En lo que respecta a los resultados en los que el número de eventos fue cero, se calculó una diferencia de riesgos (DR) no ajustada. Para las DR o los RR no ajustados, se calcularon los intervalos de confianza (IC) del 95% mediante el método de puntuación. La selección de covariables para calcular los índices de propensión se basó en la disponibilidad de datos y el conocimiento clínico. Las covariables consideradas para su inclusión en el análisis de los índices de propensión fueron la edad, el sexo, el resultado de la baciloscopia al inicio, el estado con respecto a la infección por el VIH (incluido el estado respecto al TAR), los antecedentes de tratamiento previo (entre ellos, si la infección previa era farmacorresistente), el índice de masa corporal, el estado respecto al tabaquismo, el diagnóstico de diabetes, la presencia de cavernas al inicio, la presencia de enfermedad bilateral y la resistencia a las fluoroquinolonas. Para calcular los RRa, se utilizó la imputación múltiple mediante ecuaciones en cadena utilizando la estrategia de estratificación por el índice de propensión para tener en cuenta los datos faltantes en posibles factores de confusión cuando la proporción de valores faltantes de un factor de confusión era inferior al 45%.
Cronología del seguimiento para las comparaciones entre esquemas
Los análisis realizados para esta revisión de la evidencia combinaron resultados de cohortes con diferentes períodos de seguimiento tras el inicio del tratamiento. Hubo diferencias en el período de seguimiento entre las distintas cohortes (de 5,5 meses a 24 meses) y dentro de una misma cohorte (por ejemplo, el conjunto de datos de pacientes individuales de la OMS del 2021 combinaba múltiples cohortes con diferentes períodos de seguimiento). El período de seguimiento se dividió en el tiempo transcurrido entre el inicio del tratamiento y su finalización, y el período comprendido entre la finalización del tratamiento y el final del seguimiento. En el caso de los esquemas acortados, el seguimiento posterior al tratamiento era particularmente importante, dado que tasas de recaída mayores pueden ser consecuencia de tratamientos acortados que no eliminan completamente M. tuberculosis. En la medida de lo posible, era importante que, en una comparación, el período de seguimiento de los dos grupos fuera equivalente, para que la probabilidad de muerte o de recaída de los participantes fuera similar. En estos análisis, el período de seguimiento se midió a partir de la fecha de inicio del tratamiento y no después de la fecha de finalización del tratamiento, a fin de minimizar el efecto de las diferencias en el período total de seguimiento.
Estos fueron los principios de contabilización de los períodos de seguimiento:
- Cuando fue posible, el seguimiento de los participantes de los grupos de intervención y de referencia se llevó a cabo durante el mismo período total, de modo que la probabilidad de obtener resultados negativos (por ejemplo, la muerte) fuera la misma en ambos grupos.
- Limitación del seguimiento a 24 meses después del inicio del tratamiento en todas las cohortes. No se hicieron análisis en los que tanto en la cohorte de la intervención como en la de comparación el seguimiento fuera superior a 24 meses. La evidencia acumulada a partir de ensayos del tratamiento contra la TB muestra que es probable que haya una alta proporción de recaídas en los 12 o incluso los 6 meses siguientes a la suspensión del tratamiento (25).
- Elección de un análisis principal que optimizara el número de participantes incluidos en ambos grupos. En el caso de los esquemas acortados (6-9 meses), se incluyó el período de seguimiento en la comparación para poder captar las recaídas.
En la medida de lo posible, se realizaron análisis de sensibilidad adicionales para evaluar el efecto del período de seguimiento en los resultados del tratamiento.
Resumen de la evidencia sobre los efectos deseables e indeseables y la certeza en la evidencia
La evidencia sobre los nuevos esquemas de tratamiento para fundamentar las preguntas PICO se obtuvo de dos ensayos. Incluía información sobre un total de 419 de los 423 participantes inscritos en 4 grupos del ensayo TB-PRACTECAL y sobre 172 de los 181 participantes inscritos en 4 grupos del ensayo ZeNix¹⁶.
Los datos de los pacientes de los grupos pertinentes de estos ensayos se utilizaron en cada una de las comparaciones que condujeron a las conclusiones y a la recomendación final sobre el uso de los esquemas de BPaLM y BPaL. Aunque el ensayo TB-PRACTECAL no se diseñó para comparar los esquemas en investigación entre sí y con el tratamiento de referencia, las comparaciones de los diferentes grupos del ensayo con el grupo de BPaLM (subpreguntas PICO 6.2-6.6) se llevaron a cabo para ayudar al grupo de expertos a tomar las decisiones finales.
Subpregunta PICO 3.2
Se comparó el grupo de BPaL 1200-9 del ensayo ZeNix (en el que se utilizó linezolid en dosis de 1200 mg al día durante 9 semanas) con el grupo de BPaL 1200-26 (en el que se empleó linezolid en dosis de 1200 mg al día durante 26 semanas) en la misma población de pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas. El análisis principal se realizó 12 meses después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron BPaL con linezolid 1200-9 (n = 43), en comparación con los participantes con los mismos patrones de resistencia que recibieron BPaL con linezolid 1200-26 (n = 44), presentaron:
- menores niveles de éxito del tratamiento (93% frente al 98%), es decir, una reducción relativa del 5% (RR: 0,95; IC del 95%: 0,87, 1,05);
- mayores niveles de fracaso del tratamiento y de recaída (4,7% frente al 2,3%); esto es, un aumento relativo al doble (RR: 2,1; IC del 95%: 0,19, 22);
- mayores niveles de mortalidad (2,3% frente al 0%), es decir, un aumento absoluto del 2% (DR = 0,02; IC del 95%: –0,06, 0,12);
- los mismos niveles de pérdida de contacto durante el seguimiento (0% frente al 0%), es decir, una diferencia absoluta del 0% (DR = 0,00; IC del 95%: −0,08, 0,08);
- menores niveles de eventos adversos (16% frente al 18%), es decir, una reducción relativa del 10% (RR: 0,90; IC del 95%: 0,36, 2,3); y
- los mismos niveles de amplificación de la farmacorresistencia (0% frente al 0%), es decir, una diferencia absoluta del 0% (DR = 0,00; IC del 95%: −0,08, 0,08).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL con linezolid 1200-9 eran escasos y que los efectos indeseables eran moderados en comparación con el esquema de BPaL con linezolid 1200-26. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL con linezolid 1200-26.
Conclusión
Se sugiere usar 1200 mg de linezolid durante 26 semanas, en lugar de 1200 mg de linezolid durante 9 semanas, como parte del esquema de BPaL en la población adulta con TB-RR/MDR o TB-pre-XDR.
Subpregunta PICO 3.3
Se comparó el grupo de BPaL 600-26 del ensayo ZeNix (en el que se utilizó linezolid en dosis de 600 mg al día durante 26 semanas) con el grupo de BPaL 1200-26 (en el que se empleó linezolid en dosis de 1200 mg al día durante 26 semanas) en la misma población de pacientes con TB-RR/ MDR, con o sin resistencia a las fluoroquinolonas. El análisis principal se realizó 12 meses después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron BPaL con linezolid 600-26 (n = 43), en comparación con los participantes con los mismos patrones de resistencia que recibieron BPaL con linezolid 1200-26 (n = 44), presentaron:
- mayores niveles de éxito del tratamiento (100% frente al 98%), es decir, un aumento relativo del 2% (RR: 1,02; IC del 95%: 0,98, 1,07);
- menores niveles de fracaso del tratamiento y de recaída (0% frente al 2,3%), es decir, una reducción absoluta del 2% (DR: –0,02; IC del 95%: –0,12, 0,06);
- menores niveles de eventos adversos de grado 3-5 (14% frente al 18,6%), es decir, una reducción relativa del 23% (RR: 0,77; IC del 95%: 0,29, 2,03); y
- los mismos niveles de mortalidad (0% frente al 0%), pérdida de contacto durante el seguimiento (0% frente al 0%) o amplificación de la farmacorresistencia (0% frente al 0%).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL con linezolid 600-26 eran moderados y que los efectos indeseables eran triviales en comparación con el esquema de BPaL con linezolid 1200-26. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL con linezolid 600-26.
Conclusión
Se sugiere usar 600 mg de linezolid durante 26 semanas, en lugar de 1200 mg de linezolid durante 26 semanas, como parte del esquema de BPaL en la población adulta con TB-RR/MDR o TB-pre-XDR.
Subpregunta PICO 3.4
Se comparó el grupo de BPaL 600-9 del ensayo ZeNix (en el que se utilizó linezolid en dosis de 600 mg al día durante 9 semanas) con el grupo de BPaL 1200-26 (en el que se empleó linezolid en dosis de 1200 mg al día durante 26 semanas) en la misma población de pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas. El análisis principal se realizó 12 meses después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron BPaL con linezolid 600-9 (n = 42), en comparación con los participantes con los mismos patrones de resistencia que recibieron BPaL con linezolid 1200-26 (n = 44), presentaron:
- menores niveles de éxito del tratamiento (93% frente al 98%), es decir, una reducción relativa del 5% (RR: 0,95; IC del 95%: 0,86, 1,05);
- mayores niveles de fracaso del tratamiento y de recaída (4,8% frente al 2,3%), es decir, un aumento del doble (RR: 2,10; IC del 95%: 0,20, 22,26);
- mayores niveles de pérdida de contacto durante el seguimiento (2,4% frente al 0%), es decir, un aumento absoluto del 2% (DR = 0,02; IC del 95%: –0,06, 0,12);
- menores niveles de eventos adversos de grado 3-5 (14,3% frente al 18,2%), es decir, una reducción relativa del 21% (RR: 0,79; IC del 95%: 0,30, 2,07); y
- los mismos niveles de mortalidad (0% frente al 0%) o de amplificación de la farmacorresistencia (0% frente al 0%).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL con linezolid 600-9 eran escasos y que los efectos indeseables eran moderados en comparación con el esquema de BPaL con linezolid 1200 26. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL con linezolid 1200-26.
Conclusión
Se sugiere usar 1200 mg de linezolid durante 26 semanas, en lugar de 600 mg de linezolid durante 9 semanas, como parte del esquema de BPaL en la población adulta con TB-RR/MDR o TB-pre-XDR.
Pregunta PICO 3: Conclusión intermedia abreviada
La evaluación de la pregunta PICO 3 posibilitó la decisión sobre la dosis óptima de linezolid y la duración óptima de su administración en los esquemas de BPaLM y BPaL, y limitó las comparaciones posteriores con el esquema de intervención a esta dosis y duración específicas del tratamiento con linezolid: BPaL (600 mg, 26 semanas).
Subpregunta PICO 4.1
El grupo tratado con BPaL 600-26 en el ensayo ZeNix (en el que se utilizó linezolid en dosis de 600 mg al día durante 26 semanas y cuya población incluía a pacientes con TB-RR/MDR con resistencia a las fluoroquinolonas) se comparó con una cohorte de pacientes con TB-RR/MDR con resistencia a las fluoroquinolonas del conjunto de datos de pacientes individuales del 2021 que siguieron esquemas alargados para el tratamiento de la TB-RR/MDR, diseñados de conformidad con las directrices de la OMS del 2020. El análisis principal se realizó 18 meses después de iniciar el tratamiento.
Los participantes con TB-pre-XDR (TB-RR/MDR con resistencia a las fluoroquinolonas) pulmonar que recibieron el esquema de BPaL 600-26 (n = 33), en comparación con los participantes que recibieron esquemas alargados contra la TB-RR/MDR (n = 839), presentaron:
- mayores niveles de éxito del tratamiento (100% frente al 75%), es decir, un aumento relativo del 34% (RR: 1,34; IC del 95%: 1,20, 1,40);
- menores niveles de fracaso del tratamiento y de recaída (0% frente al 6,6%), es decir, una reducción absoluta del 7% (DR: –0,07; IC del 95%: –0,08, –0,04);
- menores niveles de mortalidad (0% frente al 9,9%), es decir, una reducción absoluta del 10% (DR: –0,10; IC del 95%: –0,12, –0,01);
- menores niveles de pérdida de contacto durante el seguimiento (0% frente al 9,1%), es decir, una reducción absoluta del 9% (DR: –0,09; IC del 95%: –0,11, –0,01); mayores niveles de eventos adversos (15% frente al 4,4%), es decir, un aumento de 3,4 veces (RR: 3,44; IC del 95%: 1,44, 8,17); y
- menores niveles de amplificación de la farmacorresistencia (0% frente al 7,4%), es decir, una reducción absoluta del 7% (DR: –0,07; IC del 95%: –0,09, –0,03).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL con linezolid 600-26 eran notables y que los efectos indeseables eran moderados en comparación con esquemas alargados recomendados por la OMS. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL con linezolid 600-26.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid y linezolid (BPaL) en lugar de un esquema alargado (18 meses) en pacientes con TB-RR/MDR y resistencia a las fluoroquinolonas (TB-pre-XDR) que o bien no han estado expuestos previamente a la bedaquilina y al linezolid o bien lo han estado durante menos de 1 mes.
Pregunta PICO 4: Conclusión intermedia
La evaluación de la pregunta PICO 4 dio lugar a la recomendación condicional del uso del esquema de BPaL (600 mg, 26 semanas) en lugar de los esquemas alargados actualmente recomendados en pacientes con TB-RR/MDR y resistencia adicional a las fluoroquinolonas (TB-pre-XDR).
Subpregunta PICO 5.1
El grupo tratado con BPaL 600-26 en el ensayo ZeNix (en el que se utilizó el linezolid en dosis de 600 mg al día durante 26 semanas y cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas) se comparó con una cohorte de pacientes con TB-RR/MDR sin resistencia a las fluoroquinolonas tratados en Sudáfrica con el esquema de 9 meses con etionamida durante 4 meses recomendado por la OMS. El análisis principal se realizó 12 meses después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaL 600-26 (n = 43), en comparación con los participantes con TB-RR/MDR (sin resistencia a las fluoroquinolonas) que recibieron el esquema de 9 meses con etionamida (n = 785), presentaron:
- mayores niveles de éxito del tratamiento (100% frente al 69%), es decir, un aumento relativo del 45% (RR: 1,45; IC del 95%: 1,32, 1,53);
- menores niveles de fracaso del tratamiento y de recaída (0% frente al 1,3%), es decir, una reducción absoluta del 1% (DR: –0,01; IC del 95%: –0,02, 0,07);
- menores niveles de mortalidad (0% frente al 19%), es decir, una reducción absoluta del 19%;
- (DR: –0,19; IC del 95%: –0,22, –0,1);
- menores niveles de pérdida de contacto durante el seguimiento (0% frente al 11%), es decir, una reducción absoluta del 11% (DR: –0,11; IC del 95%: –0,14, –0,03); y
- los mismos niveles de amplificación de la farmacorresistencia (0% frente al 0%), es decir, una diferencia absoluta del 0% (DR = 0,00; IC del 95%: −0,01, 0,08).
Se observaron eventos adversos de grado 3-5 en el 14% de los participantes que recibieron el esquema de BPaL 600-26, pero no se pudo hacer una comparación, ya que no se disponía de datos de los participantes que recibieron el esquema de 9 meses con etionamida.
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL con linezolid 600-26 eran notables y que los efectos indeseables eran moderados en comparación con el esquema de 9 meses con etionamida recomendado por la OMS. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL con linezolid 600-26.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid y linezolid (BPaL) en lugar de un esquema de 9 meses (con etionamida) en pacientes con TB-RR/MDR sin resistencia a las fluoroquinolonas que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Subpregunta PICO 5.2
El grupo tratado con BPaL 600-26 en el ensayo ZeNix (en el que se utilizó el linezolid en dosis de 600 mg al día durante 26 semanas y cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas) se comparó con una cohorte de pacientes con TB-RR/MDR sin resistencia a las fluoroquinolonas del conjunto de datos de pacientes individuales del 2021, que seguían esquemas alargados contra la TB-RR/MDR, diseñados de conformidad con las directrices de la OMS del 2020. El análisis principal se realizó 18 meses después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaL 600-26 (n = 43), en comparación con los participantes con TB-RR/MDR (sin resistencia a las fluoroquinolonas) que recibieron esquemas alargados recomendados por la OMS (n = 850), presentaron:
- mayores niveles de éxito del tratamiento (98% frente al 74%), es decir, un aumento relativo del 32% (RR: 1,32; IC del 95%: 1,19, 1,39);
- menores niveles de fracaso del tratamiento y de recaída (2,3% frente al 3,3%), es decir, una reducción relativa del 29% (RR: 0,71; IC del 95%: 0,12, 3,8);
- menores niveles de mortalidad (0% frente al 11%), es decir, una reducción absoluta del 11%
- (DR: –0,11; IC del 95%: –0,13, –0,03);
- menores niveles de pérdida de contacto durante el seguimiento (0% frente al 12%), es decir, una reducción absoluta del 12% (DR: –0,12; IC del 95%: –0,14, –0,04);
- mayores niveles de eventos adversos de grado 3-5 (14% frente al 5%), es decir, un aumento relativo del cuádruple (RRa: 3,99; IC del 95%: 1,67, 9,57); y
- menores niveles de amplificación de la farmacorresistencia (0% frente al 2,4%), es decir, una reducción absoluta del 2% (DR: –0,02; IC del 95%: –0,04, 0,06).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL con linezolid 600-26 eran notables y que los efectos indeseables eran moderados en comparación con esquemas alargados recomendados por la OMS. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL con linezolid 600-26.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid y linezolid (BPaL) en lugar de esquemas alargados (18 meses) en pacientes con TB-RR/MDR y sin resistencia a las fluoroquinolonas que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Subpregunta PICO 5.3
El grupo tratado con BPaL 600-26 en el ensayo ZeNix (en el que se utilizó el linezolid en dosis de 600 mg al día durante 26 semanas y cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas) se comparó con una cohorte de pacientes con TB-RR/ MDR sin resistencia a las fluoroquinolonas tratados en Sudáfrica con un esquema de 9 meses con administración de linezolid . El análisis principal se realizó 12 meses después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaL con linezolid 600-26 (n = 43), en comparación con los participantes con TB-RR/MDR (sin resistencia a las fluoroquinolonas) que recibieron un esquema de 9 meses con linezolid (n = 4216), presentaron:
- mayores niveles de éxito del tratamiento (100% frente al 66%), es decir, un aumento relativo del 52% (RR: 1,52; IC del 95%: 1,38, 1,55);
- menores niveles de fracaso del tratamiento y de recaída (0% frente al 1,2%), es decir, una reducción absoluta del 1% (DR: –0,01; IC del 95%: –0,02, 0,07);
- menores niveles de mortalidad (0% frente al 18%), es decir, una reducción absoluta del 18%
- (DR: –0,18; IC del 95%: –0,19, –0,1);
- menores niveles de pérdida de contacto durante el seguimiento (0% frente al 15%), es decir, una reducción absoluta del 15% (DR: –0,15; IC del 95%: –0,16, –0,07);
- mayores niveles de eventos adversos de grado 3-5 (14% frente al 4,9%), es decir, un aumento del triple (RRa: 2,92; IC del 95%: 1,38, 6,18); y
- menores niveles de amplificación de la farmacorresistencia (0% frente al 0,6%), es decir, una reducción absoluta del 1% (DR: –0,01; IC del 95%: –0,01, 0,08).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL con linezolid 600-26 eran notables y que los efectos indeseables eran moderados en comparación con el esquema de 9 meses con linezolid. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL con linezolid 600-26.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid y linezolid (BPaL) en lugar de un esquema de 9 meses (con linezolid) en pacientes con TB-RR/MDR sin resistencia a las fluoroquinolonas que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Pregunta PICO 5: Conclusión intermedia abreviada
Las tres evaluaciones realizadas en el marco de la pregunta PICO 5 dieron lugar a las recomendaciones condicionales del esquema de BPaL (600 mg, 26 semanas) en lugar del esquema actualmente recomendado de 9 meses con etionamida (subpregunta PICO 5.1), de los esquemas alargados (18 meses) (subpregunta PICO 5.2) y del nuevo esquema de 9 meses en el que la etionamida se sustituye por el linezolid administrado durante 2 meses (subpregunta PICO 5.3) en pacientes con TB-RR/MDR pulmonar sin resistencia a las fluoroquinolonas.
Subpregunta PICO 6.1
Se comparó el grupo del esquema de BPaLM del ensayo TB-PRACTECAL, cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas (TB-RR/MDR o TB-pre-XDR) con el grupo comparativo del ensayo TB-PRACTECAL, en el que se incluyó a pacientes con TB-RR/ MDR o TB-pre-XDR tratados con múltiples esquemas locales de referencia recomendados por la OMS en el momento en que se realizó el ensayo (incluido un esquema de 9-12 meses de duración que contenía medicamentos inyectables, un esquema de 18-24 meses recomendado por la OMS [antes del 2019], un esquema totalmente oral de 9-12 meses y un esquema totalmente oral de 18-20 meses). El análisis principal se realizó 72 semanas después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaLM (n = 62), en comparación con los participantes que recibieron los esquemas de referencia recomendados por la OMS utilizados en el ensayo TB-PRACTECAL (n = 66), presentaron:
- mayores niveles de éxito del tratamiento (89% frente al 52%), es decir, un aumento relativo del 73% (RRa: 1,73; IC del 95%: 1,31, 2,27);
- menores niveles de fracaso del tratamiento y de recaída (8% frente al 26%), es decir, una reducción relativa del 74% (RRa: 0,26; IC del 95%: 0,10, 0,71);
- menores niveles de mortalidad (0% frente al 3,0%), es decir, una reducción absoluta del 3% (DR: –0,03; IC del 95%: –0,10, 0,03);
- menores niveles de pérdida de contacto durante el seguimiento (3,2% frente al 20%), es decir, una reducción relativa del 84% (RR: 0,16; IC del 95%: 0,04, 0,61);
- menores niveles de eventos adversos de grado 3-5 (21% frente al 51%), es decir, una reducción relativa del 59% (RRa: 0,41; IC del 95%: 0,26, 0,63); y
- menores niveles de amplificación de la farmacorresistencia (0% frente al 1,9%), es decir, una reducción absoluta del 2% (DR: –0,02; IC del 95%: –0,07, 0,02).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaLM eran notables y que los efectos indeseables eran triviales en comparación con esquemas de referencia recomendados por la OMS. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaLM.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid, linezolid y moxifloxacina (BPaLM) en lugar de un esquema de 9 meses o un esquema alargado (18 meses) en pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas, que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Subpregunta PICO 6.2
Se comparó el grupo del esquema de BPaLM del ensayo TB-PRACTECAL, cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas (TB-RR/MDR o TB-pre-XDR) con el grupo del esquema de BPaL del ensayo TB-PRACTECAL, integrado por pacientes con TB-RR/ MDR o TB-pre-XDR. El análisis principal se realizó 72 semanas después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaLM (n = 62), en comparación con los participantes que recibieron el esquema de BPaL en el ensayo TB-PRACTECAL (n = 60), presentaron:
- mayores niveles de éxito del tratamiento (89% frente al 77%), es decir, un aumento relativo del 15% (RRa: 1,15; IC del 95%: 0,95, 1,38);
- menores niveles de fracaso del tratamiento y de recaída (8,1% frente al 13%), es decir, una reducción relativa del 47% (RRa: 0,53; IC del 95%: 0,17, 1,63);
- menores niveles de pérdida de contacto durante el seguimiento (3,2% frente al 10%), es decir, una reducción relativa del 68% (RRa: 0,32; IC del 95%: 0,08, 1,34);
- ninguna diferencia en la mortalidad (0% frente al 0%), es decir, una diferencia absoluta del 0% (DR: 0; IC del 95%: −0,06, 0,06);
- mayores niveles de eventos adversos de grado 3-5 (21% frente al 20%), es decir, un aumento relativo del 7% (RRa: 1,07; IC del 95%: 0,62, 1,88); y
- menores niveles de amplificación de la farmacorresistencia (0% frente al 2,9%), es decir, una reducción absoluta del 3% (DR: –0,03; IC del 95%: –0,08, 0,01).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaLM eran moderados y que los efectos indeseables eran escasos en comparación con el esquema de BPaL. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaLM.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid, linezolid y moxifloxacina (BPaLM) en lugar de un esquema de BPaL en pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas, que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Subpregunta PICO 6.3
Se comparó el grupo del esquema de BPaLM del ensayo TB-PRACTECAL, cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas (TB-RR/MDR o TB-pre-XDR) con el grupo de BPaLC del ensayo TB-PRACTECAL, que comprendía a pacientes con TB-RR/MDR o TB-pre-XDR. El análisis principal se realizó 72 semanas después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaLM (n = 62), en comparación con los participantes que recibieron el esquema de BPaLC (n = 64) en el ensayo TB-PRACTECAL, presentaron:
- mayores niveles de éxito del tratamiento (89% frente al 81%), es decir, un aumento relativo del 11% (RRa: 1,11; IC del 95%: 0,94, 1,31);
- menores niveles de fracaso del tratamiento y de recaída (8,1% frente al 9,4%), es decir, una reducción relativa del 30% (RRa: 0,70; IC del 95%: 0,2, 2,29);
- menores niveles de mortalidad (0% frente al 1,6%), es decir, una reducción absoluta del 2% (DR: –0,02; IC del 95%: –0,08, 0,04);
- menores niveles de pérdida de contacto durante el seguimiento (3,2% frente al 7,8%); es decir, una reducción relativa del 59% (RR: 0,41; IC del 95%: 0,09, 1,77);
- menores niveles de eventos adversos de grado 3-5 (21% frente al 34%), es decir, una reducción relativa del 39% (RRa: 0,61; IC del 95%: 0,37, 1,00); y
- menores niveles de amplificación de la farmacorresistencia (0% frente al 1,9%), es decir, una reducción absoluta del 2% (DR: –0,02; IC del 95%: –0,07, 0,02).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaLM eran moderados y que los efectos indeseables eran triviales en comparación con el esquema de BPaLC. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaLM.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid, linezolid y moxifloxacina (BPaLM) en lugar de un esquema de BPaLC en pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas, que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Subpregunta PICO 6.4
Se comparó el grupo del esquema de BPaLC del ensayo TB-PRACTECAL, cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas (TB-RR/MDR o TB-pre-XDR), con el grupo comparativo del ensayo TB-PRACTECAL, que comprendía a pacientes con TB-RR/MDR o TB-pre-XDR tratados con múltiples esquemas locales de referencia recomendados por la OMS en el momento en que se realizó el ensayo (incluido un esquema de 9-12 meses de duración que incluía medicamentos inyectables, un esquema de 18-24 meses recomendado por la OMS [antes del 2019], un esquema totalmente oral de 9-12 meses y un esquema totalmente oral de 18-20 meses). El análisis principal se realizó 72 semanas después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaLC (n = 64), en comparación con los participantes que recibieron esquemas de referencia recomendados por la OMS utilizados en el ensayo TB-PRACTECAL (n = 66), presentaron:
- mayores niveles de éxito del tratamiento (81% frente al 52%), es decir, un aumento relativo del 55% (RRa: 1,15; IC del 95%: 1,15, 2,11);
- menores niveles de fracaso del tratamiento y de recaída (9,4% frente al 26%), es decir, una reducción relativa del 66% (RRa: 0,34; IC del 95%: 0,14, 0,87);
- menores niveles de mortalidad (1,6% frente al 3,0%), es decir, una reducción relativa del 48% (RR: 0,52; IC del 95%: 0,07, 3,85);
- menores niveles de pérdida de contacto durante el seguimiento (7,8% frente al 20%), es decir, una reducción relativa del 57% (RRa: 0,43; IC del 95%: 0,15, 1,23);
- menores niveles de eventos adversos de grado 3-5 (34% frente al 51%), es decir, una reducción relativa del 33% (RRa: 0,67; IC del 95%: 0,46, 0,97); y
- mayores niveles de amplificación de la farmacorresistencia (1,9% frente al 1,9%); es decir, un aumento relativo del 4% (RR: 1,04; IC del 95%: 0,19, 5,80).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaLC eran notables y que los efectos indeseables eran triviales en comparación con esquemas de referencia recomendados por la OMS. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaLC.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid, linezolid y clofazimina (BPaLC) en lugar de un esquema de 9 meses o un esquema alargado (18 meses) en pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas, que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes (esto queda anulado por las conclusiones de las subpreguntas PICO 6.5 y PICO 6.6).
Subpregunta PICO 6.5
Se comparó el grupo del esquema de BPaLC del ensayo TB-PRACTECAL, cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas (TB-RR/MDR o TB-pre-XDR), con el grupo de BPaL del ensayo TB-PRACTECAL, que comprendía a pacientes con TB-RR/MDR o TB-pre-XDR. El análisis principal se realizó 72 semanas después de iniciar el tratamiento.
Los participantes con TB-RR/MDR o TB-pre-XDR pulmonar que recibieron el esquema de BPaLC (n = 64), en comparación con los participantes que recibieron el esquema de BPaL 600-300 (n = 60), presentaron:
- mayores niveles de éxito del tratamiento (81% frente al 77%), es decir, un aumento relativo del 4% (RRa: 1,04; IC del 95%: 0,84, 1,30);
- menores niveles de fracaso del tratamiento y de recaída (9,4% frente al 13%), es decir, una reducción relativa del 14% (RRa: 0,86; IC del 95%: 0,28, 2,69);
- mayores niveles de mortalidad (1,6% frente al 0%), es decir, un aumento absoluto del 2% (DR: 0,02; IC del 95%: –0,05, 0,08);
- menores niveles de pérdida de contacto durante el seguimiento (7,8% frente al 10%), es decir, una reducción relativa del 28% (RRa: 0,72; IC del 95%: 0,21, 2,47);
- mayores niveles de eventos adversos (34% frente al 20%), es decir, un aumento relativo del 64% (RRa: 1,64; IC del 95%: 0,97, 2,79); y
- menores niveles de amplificación de la farmacorresistencia (1,9% frente al 2,9%); es decir, una reducción relativa del 35% (RR: 0,65; IC del 95%: 0,13, 3,21).
El grupo de elaboración de las directrices consideró que tanto los efectos deseables como los efectos indeseables del esquema de BPaLC eran escasos en comparación con el esquema de BPaL. Se consideró que el grado de certeza en la evidencia era muy bajo. El balance de los efectos sobre la salud no fue favorable ni a la intervención ni al esquema de comparación; sin embargo, el grupo de expertos se manifestó en contra de la intervención, teniendo en cuenta el mayor costo del esquema, la mayor carga de comprimidos o cápsulas, la menor aceptabilidad debido al cambio de coloración de la piel y otros posibles efectos adversos relacionados con la clofazimina, sin un beneficio neto apreciable en cuanto a los efectos sobre la salud.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid y linezolid (BPaL) en lugar de un esquema de BPaLC en pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas, que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Subpregunta PICO 6.6
Se comparó el grupo del esquema de BPaL del ensayo TB-PRACTECAL, cuya población incluía a pacientes con TB-RR/MDR con o sin resistencia a las fluoroquinolonas (TB-RR/MDR o TB-pre-XDR), con el grupo de comparación del ensayo TB-PRACTECAL, que comprendía a pacientes con TB-RR/MDR o TB-pre-XDR tratados con múltiples esquemas locales de referencia (incluido un esquema de 9-12 meses de duración que contenía medicamentos inyectables, un esquema de 18-24 meses recomendado por la OMS [antes del 2019], un esquema totalmente oral de 9-2 meses y un esquema totalmente oral de 18-0 meses). El análisis principal se realizó 72 semanas después de iniciar el tratamiento.
Los participantes con TB-RR/MDR (con o sin resistencia a las fluoroquinolonas) que recibieron el esquema de BPaL (n = 60), en comparación con los participantes que recibieron esquemas de referencia recomendados por la OMS utilizados en el ensayo TB-PRACTECAL (n = 66), presentaron:
- mayores niveles de éxito del tratamiento (77% frente al 52%), es decir, un aumento relativo del 47% (RRa: 1,47; IC del 95%: 1,09, 1,99);
- menores niveles de fracaso del tratamiento y de recaída (13% frente al 26%), es decir, una reducción relativa del 48% (RRa: 0,52; IC del 95%: 0,22, 1,18);
- menores niveles de mortalidad (0% frente al 3,0%), es decir, una reducción absoluta del 3% (DR: –0,03; IC del 95%: –0,10, 0,03);
- menores niveles de pérdida de contacto durante el seguimiento (10% frente al 20%), es decir, una reducción relativa del 40% (RRa: 0,60; IC del 95%: 0,24, 1,56);
- menores niveles de eventos adversos (20% frente al 51%), es decir, una reducción relativa del 62% (RR: 0,38; IC del 95%: 0,24, 0,60); y
- mayores niveles de amplificación de la farmacorresistencia (2,9% frente al 1,9%), es decir, un aumento relativo del 59% (RR: 1,59; IC del 95%: 0,32, 7,84).
El grupo de elaboración de las directrices consideró que los beneficios del esquema de BPaL eran notables y que los efectos indeseables eran triviales en comparación con esquemas de referencia recomendados por la OMS. Se consideró que el grado de certeza en la evidencia era muy bajo. Basándose en esto, el grupo de expertos determinó que el balance de los efectos sobre la salud era probablemente favorable al esquema de BPaL.
Conclusión
Se sugiere usar el esquema de tratamiento de 6 meses de duración compuesto por bedaquilina, pretomanid y linezolid (BPaL) en lugar de esquemas de 9 meses o esquemas alargados (18 meses) en pacientes con TB-RR/MDR, con o sin resistencia a las fluoroquinolonas, que o bien no han tenido exposición previa a la bedaquilina y al linezolid o bien han estado expuestos durante menos de 1 mes.
Pregunta PICO 6: Conclusión intermedia abreviada
La evaluación principal que definió la decisión general fue la de la subpregunta PICO 6.1, que dio lugar a la recomendación condicional del uso del esquema de BPaLM en lugar de la mezcla interna de esquemas de referencia que se ajustan a las recomendaciones de la OMS sobre esquemas de 9 meses o más. Las evaluaciones de los esquemas en investigación comparados entre sí y con el esquema de referencia en las subpreguntas PICO 6.2-6.6 ayudaron al grupo de expertos a tomar decisiones finales.
Resumen de la evidencia de otro tipo
Otros datos que examinó el grupo de elaboración de las directrices en relación con estas preguntas PICO fueron un análisis de la costo-eficacia, un estudio sobre la aceptabilidad y la probabilidad de implementación del esquema de BPaL, datos farmacocinéticos modelizados basados en la elaboración de un modelo farmacocinético toxicodinámico, y un resumen de datos sobre la posible toxicidad del pretomanid para la función reproductora. No se dispuso de datos de investigación adicionales durante el examen de las subpreguntas PICO 3.2-3.5.
Datos farmacocinéticos
Los primeros datos del estudio farmacocinético integrado en el ensayo TB-PRACTECAL se presentaron al panel del grupo de elaboración de las directrices en uno de los seminarios web preparatorios. Los resultados finales de este subestudio no estaban disponibles en el momento de la evaluación y no fue posible considerarlos en su totalidad.
La farmacocinética del linezolid es muy variable, y su eficacia y toxicidad dependen de factores como la sensibilidad del microorganismo patógeno, la exposición al fármaco y la combinación con otros fármacos. La toxicidad del linezolid, sobre todo cuando se utiliza en dosis más altas y durante períodos alargados, es un fenómeno conocido, y se han sugerido diversas estrategias para reducirla. Sin embargo, a excepción de los datos disponibles de los ensayos ZeNix y TB-PRACTECAL, no se han probado otras estrategias en un contexto de ensayo clínico.¹⁷
Datos sobre la toxicidad del pretomanid para la función reproductora
Se evaluaron nuevos datos sobre la seguridad del pretomanid basados en evaluaciones hormonales en cuatro ensayos clínicos y en un estudio de paternidad; estos datos han aliviado en gran medida las inquietudes previas sobre los efectos adversos relacionados con la reproducción que se observaron en estudios en animales,¹⁸ y sugieren que los efectos adversos sobre la fecundidad masculina humana son poco probables. Se está llevando a cabo un estudio de evaluación del semen en hombres que siguen un tratamiento que contiene pretomanid; en dicho estudio se abordarán las inquietudes pendientes. A continuación se ofrece un resumen de los datos preclínicos y clínicos de interés en cuanto a la toxicidad testicular del pretomanid:
- estudios toxicológicos en roedores: evidencia de toxicidad testicular directa;
- estudios toxicológicos en monos: no hay evidencia de toxicidad testicular directa; se considera que las anomalías en los espermatozoides son secundarias a un empeoramiento del estado físico;
- datos hormonales obtenidos en estudios clínicos: no hay cambios en la hormona foliculoestimulante (FSH), la hormona luteinizante (LH) ni la inhibina B, indicativos de una toxicidad testicular;
- estudio de paternidad: 44 hijos o hijas de 38 hombres (12%) que participaron en estudios del pretomanid con una duración del tratamiento de 4-6 meses; y
- estudio del semen: estudio en curso en el que se evalúa el semen en hombres que siguen tratamiento con pretomanid.
Recursos necesarios y costo-eficacia
Los costos estimados de los esquemas (para la población adulta) a precios del Servicio Farmacéutico Mundial (GDF)¹⁹ son de unos US$ 688 para el esquema de BPaL (600-26), US$ 716 para el de BPaLM (600-26), un promedio de US$ 771 para los esquemas alargados (dependiendo de la duración y la composición) y US$ 535-557 para los esquemas de 9 meses. Se disponía de datos de tres estudios sobre análisis más detallados de los recursos necesarios y la costo-eficacia; en dos de estos estudios se comparó el esquema de BPaL con esquemas alargados (18 meses) (26, 27) y en uno se compararon los esquemas de BPaL, BPaLM y BPaLC con esquemas alargados (18 meses) y con el esquema de 9 meses con etionamida (28). La aplicabilidad de los resultados de estos estudios varió según la pregunta PICO y la subpregunta PICO; el grupo de expertos hizo ciertas advertencias al comentar estos resultados (puede consultarse una información detallada en los cuadros para pasar de los datos a las decisiones según el método GRADE, en el anexo 4 en la web 4).En general, teniendo en cuenta estas tres publicaciones, las estimaciones del costo total comparativo (medicamentos y suministro) en el país parecen ser 1,4-6 veces mayores (esquemas alargados) o un 1-8% mayores (esquemas de 9 meses) en comparación con los esquemas de BPaLM y BPaL. Así pues, el grupo de expertos consideró que la introducción de los esquemas de BPaLM y BPaL probablemente supondría un gran ahorro cuando sustituyeran a los esquemas alargados (18 meses) y un ahorro moderado cuando sustituyeran a los esquemas de 9 meses.
En el estudio de costo-eficacia (28) se observó que, en la mayoría de los contextos, los esquemas de BPaLM y BPaL suponen un ahorro de costos, sobre todo debido a la reducción del período durante el que es necesaria la atención de salud y, por tanto, del número de consultas ambulatorias, días-cama de hospitalización y pruebas de laboratorio. El grupo de expertos estimó que la costo-eficacia era probablemente favorable a los esquemas de BPaLM y BPaL.
Equidad, aceptabilidad y viabilidad
El grupo de expertos consideró que la duración del tratamiento y la capacidad de descentralizar el tratamiento (para permitir el acceso en entornos remotos y desatendidos y de grupos de población desfavorecidos) afectan a la equidad. A pesar de no haber encontrado evidencia de investigación relevante, el grupo de expertos se basó en su experiencia colectiva para considerar que probablemente habría ventajas asociadas al uso de los esquemas de BPaLM y BPaL, debido a su menor complejidad y duración. Por lo tanto, el grupo de expertos consideró que el uso de los esquemas de BPaLM y BPaL probablemente aumentaría la equidad.
Se consideró que un estudio sobre la aceptabilidad y la viabilidad del esquema de BPaL desde la perspectiva del prestador (29) era una evidencia de interés para la evaluación del esquema de BPaL e indirectamente para la evaluación del esquema de BPaLM. Se trató de un estudio de métodos mixtos en una muestra representativa de trabajadores de salud y otras partes interesadas programáticas y de laboratorio que se llevó a cabo entre mayo del 2018 y mayo del 2019 en Indonesia, Kirguistán y Nigeria. Los resultados de este estudio indicaron que la aceptabilidad y la viabilidad eran altas en líneas generales. Más del 80% de participantes y partes interesadas de todos los ámbitos consideraron que el esquema de BPaL era aceptable, y el 88% de los interesados directos entrevistados afirmaron que probablemente utilizarían el esquema de BPaL cuando estuviera disponible. Los interesados directos consideraron que el esquema de BPaL reduciría la carga económica y de trabajo del sistema de salud; expresaron su preocupación por la seguridad (seguimiento) del esquema de BPaL, su eficacia a largo plazo y los requisitos regulatorios nacionales; y subrayaron la importancia de abordar las actuales limitaciones de los sistemas de salud, especialmente en los sistemas de tratamiento y seguimiento de la seguridad. Se presentaron al grupo de expertos los resultados de un segundo estudio cualitativo (30) centrado en la perspectiva del paciente; este estudio sugería que los pacientes acogerían con satisfacción el impacto favorable de un tratamiento acortado en la situación laboral.²⁰
El grupo de expertos tuvo en cuenta los resultados de los estudios y, como parte de sus deliberaciones, consideró a los pacientes y a los prestadores de atención de salud como partes interesadas clave. El grupo de expertos consideró que los siguientes aspectos eran cruciales en lo que respecta a la aceptabilidad de los esquemas de BPaLM y BPaL: la duración del esquema y las necesidades de farmacovigilancia (en relación tanto con los desplazamientos necesarios y la pérdida de ingresos y el trastorno general de la vida de los pacientes, como con la carga de trabajo para el sistema de atención de salud), así como la necesidad de pruebas de sensibilidad a fármacos. También consideró que los esquemas de BPaLM y BPaL probablemente serían aceptables. En cuanto a la viabilidad, el grupo de expertos señaló que la disponibilidad limitada de la sustancia pura de los fármacos de los esquemas de BPaLM y BPaL para su uso en pruebas de sensibilidad a fármacos es un posible obstáculo para su introducción; asimismo, indicó que los datos sobre la concentración crítica de pretomanid para su uso en las pruebas de sensibilidad a fármacos son limitados. Sin embargo, dada la menor duración, complejidad y carga de trabajo asociadas de los esquemas de BPaLM y BPaL, el grupo de expertos consideró que probablemente es factible implantar este esquema.
14 Disponible en https://clinicaltrials.gov/ct2/home.
15 El protocolo del ensayo puede consultarse en https://trialsjournal.biomedcentral.com/articles/10.1186/s13063-022-06331-8.
16 En cada conjunto de datos se excluyó a varios participantes debido a la resistencia no confirmada a la rifampicina
17 Tal como se presentó en la revisión de expertos (por parte del Dr. J W. Alffenaar, Universidad de Sídney) al panel del grupo de elaboración de las directrices en uno de los seminarios web preparatorios.
18 Se ha observado que el pretomanid causa atrofia testicular y alteraciones de la fecundidad en ratas macho
19 Los precios estimados de los esquemas se calcularon utilizando el precio medio ponderado de cada medicamento (el precio medio ponderado tiene en cuenta los diferentes precios de cada proveedor de ese medicamento ponderados por la asignación de cuota de mercado recibida de cada licitación del GDF, la duración indicada [en meses] y suponiendo 30 días de tratamiento al mes). Los costos finales reales pueden variar en función de los productos suministrados.
20 Sin publicar; por cortesía de Beverley Stringer, unidad Manson, Médicos Sin Fronteras.
 Reacción
Reacción