Enlaces transversales de Book para 4.3.1 Decision pathway for Algorithm 3 – DST for second-line drugs for people with RR-TB or MDR-TB
Consideraciones generales
- Un esquema acortado totalmente oral que contiene bedaquilina durante 9 a 12 meses es la opción preferida en los pacientes con TB-MDR/RR que reúnen los criterios (4).
- El esquema preferido contiene bedaquilina, levofloxacina o moxifloxacina, etionamida, etambutol, isoniacida (dosis alta), pirazinamida y clofazimina (4-6 meses de BDQ-LFX/MFX-ETO-EMB-PZA-INH-CFZ y 5 meses de LFX/MFX-CFZ-PZA-EMB).
- Los esquemas individualizados más largos, totalmente orales , diseñado usando el agrupamiento prioritario de fármacos de la OMS, todavía pueden utilizarse en los pacientes con TB-RR/MDR que no cumplen los criterios de selección para un esquema acortado totalmente oral que contiene bedaquilina.
- Como una cuestión prioritaria, los medicamentos inyectables (por ejemplo, AMK) deberían eliminarse de manera gradual de todos los esquemas de tratamiento y reemplazarlos por BDQ. Si la AMK todavía se utiliza en el país, la OMS recomienda que en el caso de pacientes para quienes se considera el esquema acortado de la TB-MDR que contiene AMK, es necesario demostrar la sensibilidad a la FQ y la AMK (por ejemplo, no detectar ninguna mutación en la LPA-SL) antes de iniciar el esquema acortado contra la TB-MDR que contiene AMK (véase el algoritmo 3 de los algoritmos diagnósticos modelo recomendados por la GLI [29]).
- En las directrices de la OMS se subraya la importancia de realizar PSF antes del tratamiento, sobre todo de los fármacos para los cuales existen PDRm disponibles.
- Existen pruebas moleculares rápidas aprobadas por la OMS para RIF, INH y FQ. Las pruebas genéticas, incluida la secuenciación del genoma completo, están en vía de desarrollo para algunos otros fármacos incluidos en los esquemas de la TB MDR.
- Se cuenta con PSF fenotípicas de fiables para RIF, INH, FQ, PZA, BDQ, CFZ, LZD, AMK y DLM. Los algoritmos de pruebas basados en el cultivo y la PSF fenotípica se describen en el marco normativo de la OMS (30) y el manual técnico (5) correspondientes.
- No se cuenta con ningún método fenotípico de PSF fiable para EMB, etionamida/ protionamida, cicloserina/terizidona, imipenem-cilastatina/meropenem y PZA; en consecuencia, los resultados no deberían usarse en la toma de decisiones clínicas.
- Si en el país no se cuenta con una PSF fenotípica a los fármacos de segunda línea, las muestras o los aislamientos clínicos se pueden enviar a un laboratorio exterior para realizar la prueba (por ejemplo, un laboratorio supranacional de referencia de la OMS).
- En la actualidad, la disponibilidad de PSF para BDQ y LZD es limitada en muchos entornos y es probable que los niveles de resistencia sean muy bajos. Por consiguiente, en este momento, la realización de PSF para BDQ y LZD no es esencial antes de utilizar estos medicamentos; sin embargo, se recomienda firmemente a los programas nacionales de TB que comiencen a aumentar la capacidad de vigilancia de la farmacorresistencia a estos fármacos. Si durante un tratamiento existe presunción de resistencia y no se cuenta con la PSF, se deberían conservar las cepas y derivarlas a un laboratorio supranacional de referencia para realizar otras pruebas.
- No retrasar el inicio del tratamiento en espera de los resultados de la PSF.
- En la actualidad, la LPA SL es la única prueba molecular rápida aprobada por la OMS para la detección de resistencia a la FQ.
- La precisión diagnóstica es equivalente cuando la LPA SL se realiza directamente en el esputo o a partir de aislamientos obtenidos en cultivo. Puede usarse la LPA SL en las muestras con baciloscopia positiva o baciloscopia negativa, aunque ocurre una tasa más alta de resultados indeterminados con las muestras con baciloscopia negativa.
- Solo se recomienda utilizar la LPA SL con las muestras de esputo o los aislamientos del complejo M. tuberculosis. Las pruebas de laboratorio con otros tipos de muestras se deben basar en el cultivo y la PSF fenotípica.
- La utilización de la LPA SL es apropiada a nivel del laboratorio central o el laboratorio nacional de referencia. También puede utilizarse a nivel regional, cuando se cuenta con la infraestructura, los recursos humanos y los sistemas de garantía de la calidad adecuados. La introducción de la LPA SL depende de la disponibilidad de un sistema fiable de transporte de muestras y un mecanismo eficiente de comunicación de los resultados.
- La utilización de la LPA SL para detectar la resistencia a la FQ no elimina la necesidad de realizar PSF convencionales basadas en el cultivo, que serán necesarias para determinar la resistencia a otros fármacos contra la TB y vigilar la aparición de nuevas farmacorresistencias.
Ruta de las decisiones en el algoritmo 3
- Iniciar sin demora en el paciente un esquema para TB-MDR, de acuerdo con las directrices nacionales y las recomendaciones de la OMS más recientes sobre el uso de esquemas de tratamiento acortados totalmente orales que contienen BDQ, con una duración de 9 a 12 meses (3,4).
- Si las pruebas molecular y fenotípica se realizan en el mismo laboratorio, puede ser suficiente obtener una sola muestra. Si las pruebas se realizan en dos laboratorios, se pueden obtener dos muestras y realizar las pruebas molecular y fenotípica de manera simultánea. De ser necesario, transportar las muestras de esputo o los aislamientos clínicos al laboratorio de pruebas apropiado.
- Realizar la LPA-SL con el fin de detectar mutaciones asociadas con la resistencia a la FQ.
- Si la LPA-SL detecta una o varias mutaciones asociadas con la resistencia a la FQ 3 A :
- Iniciar en los pacientes con TB MDR/RR y con resistencia a las FQ un esquema individualizado más largo, diseñado usando el agrupamiento prioritario de fármacos de la OMS recomendado en el 2018.
- Obtener una muestra y enviarla para PSF fenotípica a los fármacos del grupo A, B y C de la OMS (por ejemplo, PSF para DLM y LZD), si aún no se ha realizado la PSF como se describe en el paso 6. También se pueden realizar pruebas moleculares (por ejemplo, LPA PL para ETO).
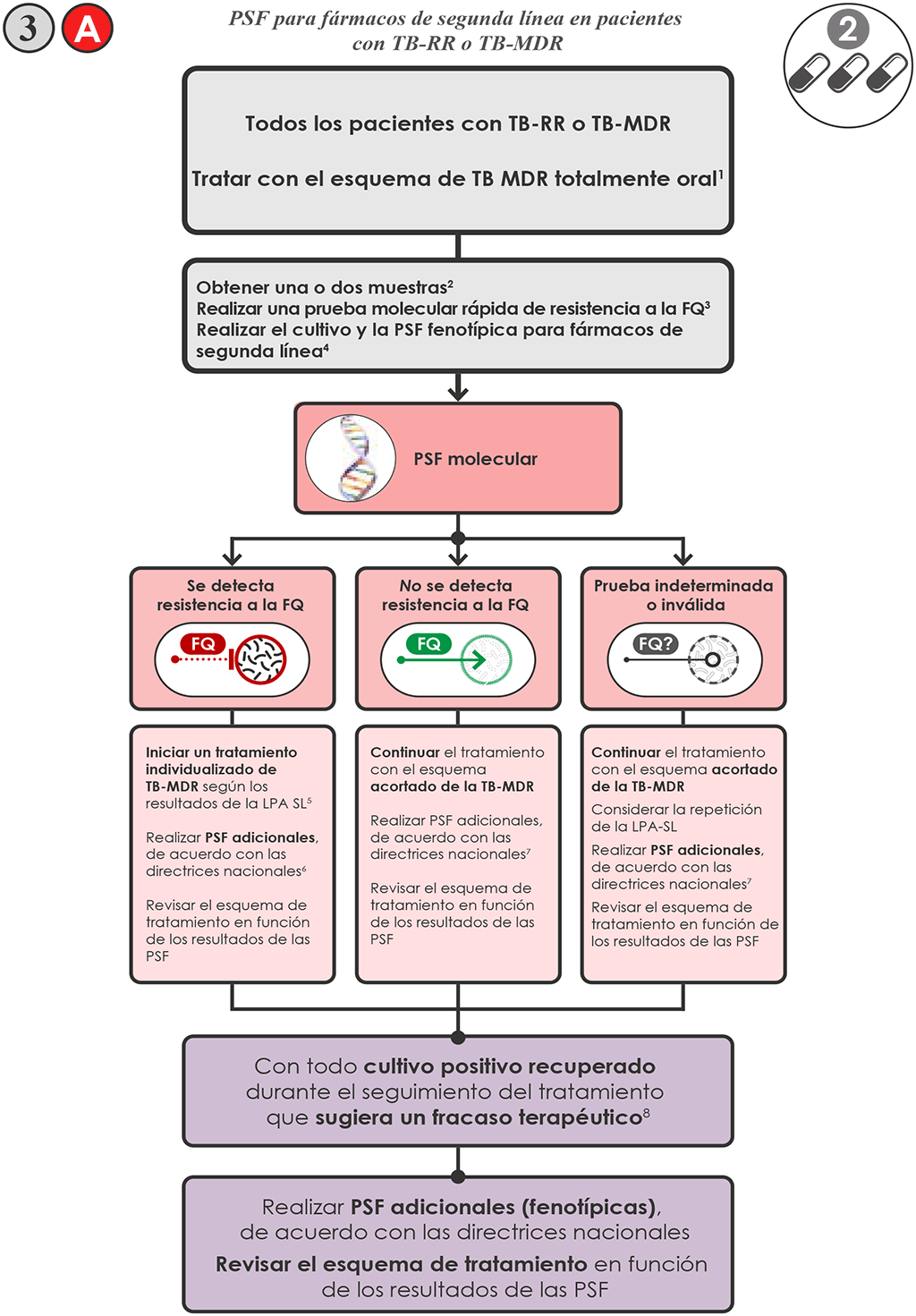
- Si la LPA SL es negativo para mutaciones asociadas con la resistencia a las FQ 3 A:
- Continuar en los pacientes el esquema de TB-MDR acortado, totalmente oral que contiene BDQ, en espera de los resultados de la PSF fenotípica (paso 6).
- En entornos con una prevalencia general alta de resistencia a las FQ o en los pacientes considerados con riesgo alto de resistencia, enviar una muestra para cultivo y PSF fenotípica a las FQ, porque la sensibilidad de la LPA SL para detectar mutaciones asociadas con la resistencia a la FQ es alrededor de 86%. La PSF fenotípica debe incluir el examen de la resistencia a las FQ utilizadas en el país. Modificar el esquema según sea necesario, en función de los resultados de la PSF fenotípica.
- Realizar el cultivo y la PSF fenotípica de cada uno de los fármacos incluidos en el esquema de tratamiento, para los cuales haya métodos exactos y reproducibles 3 B . En el caso de los esquemas preferidos, hay métodos fiables de PSF para BDQ, FQ, CFZ, PZA e INH.
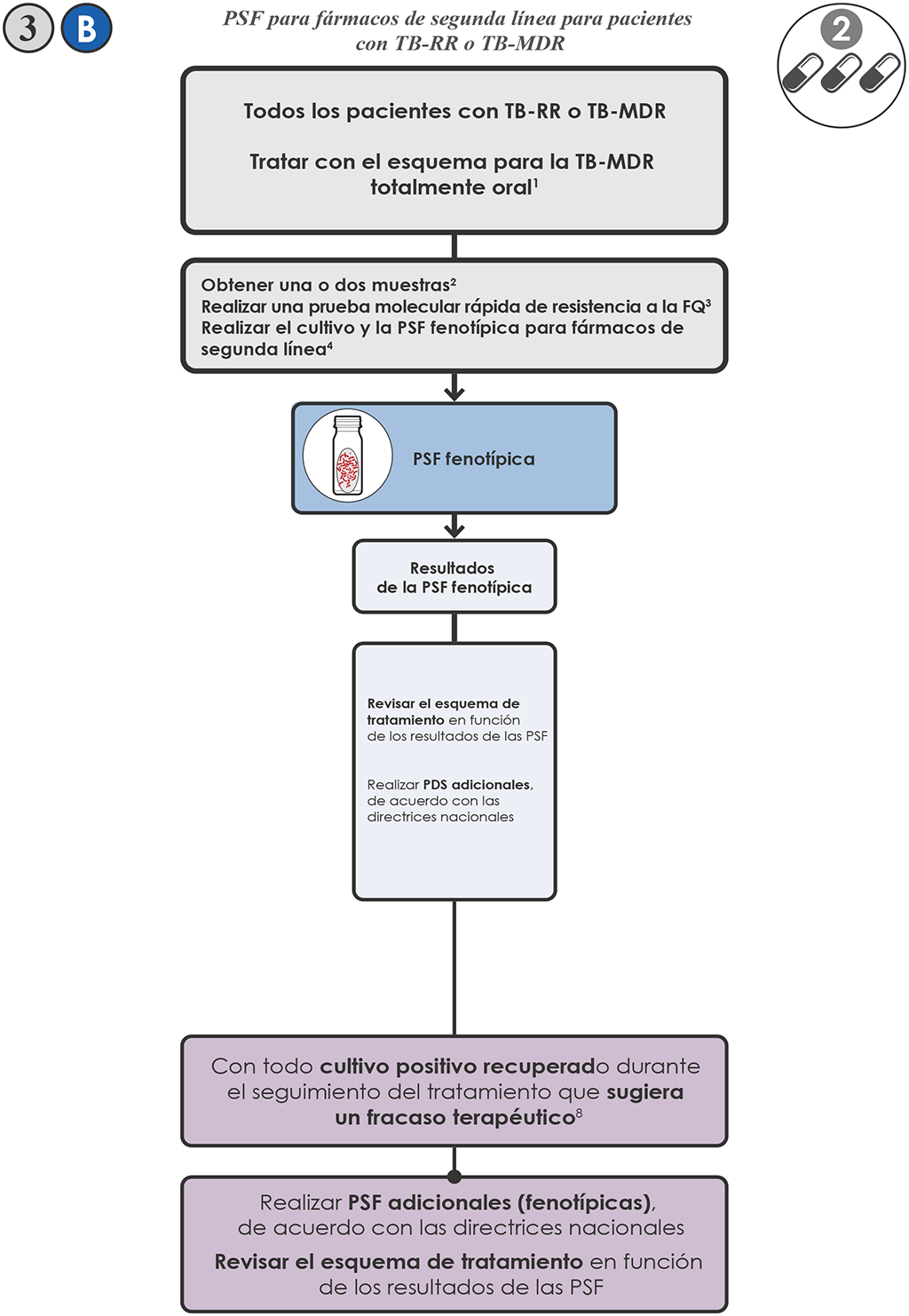
- Si el aislamiento es sensible a todos los fármacos, continuar el esquema preferido de TB-MDR.
- Si se detecta resistencia a algún fármaco, iniciar en el paciente un esquema individualizado de TB-MDR más largo, diseñado usando el agrupamiento prioritario de fármacos de la OMS recomendado en el 2018.
- Para todos los pacientes, asegurarse de que el seguimiento del tratamiento incluye la obtención de muestras para el cultivo, según se describe en las directrices unificadas de la OMS (3). Con todo cultivo positivo que sugiera un fracaso terapéutico se debe realizar la PSF fenotípica. Modificar el esquema según sea necesario, en función de los resultados de la PSF.
- La OMS recomienda dar seguimiento a todos los pacientes tratados con un esquema de TB MDR con el fin de observar la respuesta al tratamiento mediante cultivos y baciloscopias de esputo. Es aconsejable repetir el cultivo de esputo con intervalos mensuales.
- Aunque el riesgo de un fracaso terapéutico aumenta con cada mes adicional sin conversión bacteriológica, no se ha definido un umbral específico que pueda servir de marcador fiable de un esquema que fracasa. La elección del umbral dependerá del deseo del médico de reducir al mínimo el riesgo de un fracaso y, en especial, limitar el riesgo de prolongar un esquema que está fracasando.
Consideraciones para la utilización de la LPA-SL
Las LPA-SL son análisis de ADN en tiras, aprobados por la OMS, que determinan el tipo de farmacorresistencia del complejo M. tuberculosis según el patrón de fijación de los amplicones (productos de amplificación del ADN) a sondas que se dirigen a las mutaciones más frecuentes que confieren resistencia a los principales fármacos de segunda línea (FQ y AMK) y a sondas que se unen a la secuencia de ADN de tipo salvaje correspondiente (9,10). Las mutaciones se detectan mediante la fijación a las sondas específicas para las mutaciones que ocurren con más frecuencia (sondas MUT) o se infieren ante la ausencia de hibridación (es decir, de fijación) de los amplicones a las sondas de tipo salvaje correspondientes.
Según la región específica del genoma que investiga la sonda de la LPA-SL, la OMS ya sea, recomienda o sugiere como óptima, una o varias medidas diagnósticas consecutivas, en función del fármaco específico en cuestión, para orientar mejor el esquema de tratamiento. Cuando se utiliza la secuenciación para detectar la mutación específica, se pueden encontrar orientaciones para interpretar las mutaciones individuales en la guía técnica de la OMS y FIND sobre el uso de tecnologías de secuenciación de nueva generación (31). Por ejemplo, si se detectan mutaciones asociadas con la concentración inhibitoria mínima (CIM) de MFX por encima de la concentración crítica, pero por debajo del valor crítico clínico de resistencia (es decir, mutaciones asociadas con un aumento de la CIM de bajo nivel), es probable que dosis altas de MFX (hasta 800 mg diarios en adultos) sean eficaces. Si se detectan mutaciones asociadas con aumentos de la CIM de MFX por encima del valor crítico clínico de resistencia (es decir, mutaciones asociadas con un aumento de la CIM de nivel alto), es poco probable que el fármaco sea efectivo (32).
Cuando se utilizan para examinar directamente muestras de esputo de pacientes con TB RR o TB MDR, las LPA-SL detectarán 86% de los pacientes con resistencia a la FQ y rara vez darán un resultado positivo en pacientes sin resistencia, según se describe en la orientación normativa de la OMS del 2016 (10). Por lo tanto, la OMS recomienda que se tomen las decisiones terapéuticas a partir de los resultados de la LPA SL, teniendo en cuenta los siguientes aspectos:
- A pesar de la especificidad y la sensibilidad adecuadas de la LPA SL para detectar la resistencia a la FQ (sensibilidad combinada de 86% y especificidad combinada de 99%) comparado con la PSF fenotípica, en algunas situaciones puede necesitarse el cultivo y la PSF fenotípica con el fin de excluir totalmente la resistencia a fármacos individuales de la clase de las FQ y también a otros fármacos de segunda línea. En concreto, se puede necesitar la PSF fenotípica en los entornos con una probabilidad preanálisis alta de resistencia a las FQ, para excluir la resistencia, cuando la LPA-SL no detecta mutaciones asociadas con resistencia.
- La LPAñSL detecta mutaciones que confieren resistencia que están fuertemente correlacionadas con la resistencia fenotípica a la ofloxacina, la gatifloxacina, la LFX y la MFX.
- Si se detectan mutaciones asociadas con un aumento de la CIM de nivel bajo (por ejemplo, se evidencian sondas MUT1, MUT2 o MUT3A en la región gyrA o sondas MUT1 o MUT2 en la región gyrB), la OMS recomienda realizar la PSF fenotípica para MFX con el fin de excluir la resistencia en el valor crítico clínico.
- Si se infieren mutaciones asociadas con un aumento de la CIM de nivel bajo por la ausencia de fijación de los amplicones a las sondas de tipo salvaje en las regiones gyrA o gyrB (es decir, no se evidencian las sondas de tipo salvaje), la OMS recomienda realizar la PSF fenotípica para MFX con el fin de excluir la resistencia en el valor crítico clínico. Las medidas de seguimiento opcionales pueden ser la secuenciación de gyrA o gyrB para detectar la mutación específica o las mutaciones silenciosas (asociadas con falsa resistencia) y la PSF fenotípica para MFX (o LFX, o ambas) en la concentración crítica.
- Con fines de registro y notificación los resultados de la LPA-SL “se detecta resistencia” y “se infiere resistencia” se deben considerar como resistentes.
 Reacción
Reacción