Enlaces transversales de Book para Annex 6. Variables to be collected for TB contact evaluation
¿Qué son los IGRA?
Los ensayos de liberación de interferón g (IGRA) son pruebas sanguíneas que ayudan al diagnóstico de la infección por M. tuberculosis (43). Al igual que la PT, los IGRA no diferencian entre la infección por TB y la TB activa. La OMS analizó en el 2017 la evidencia disponible sobre los dos IGRA más utilizados, el QuantiFERON®TB Gold in tube (QFT-GIT) y la prueba T-SPOT.TB (T-Spot), con el objeto de facilitar la recomendación de su uso para detectar a las personas con infección por TB.
¿Cómo funcionan los IGRA?
Los leucocitos de las personas con la infección por M. tuberculosis liberan interferón g (IFN-γ) cuando se ponen en contacto con antígenos derivados de M. tuberculosis. El reconocimiento de la función importante que desempeña el IFN-γ en la regulación de la respuesta inmunitaria mediada por células a la infección por M. tuberculosis, llevó al desarrollo de los IGRA (149-151). Los IGRA detectan la sensibilización a M. tuberculosis, al medir la liberación de IFN-γ en respuesta a antígenos que corresponden a M. tuberculosis. Los IGRA evalúan la respuesta a péptidos sintéticos que se superponen y representan proteínas específicas de M. tuberculosis, como el ESAT-6 (Early Secretory Antigenic Target-6) y la proteína del filtrado de cultivo 10 (CFP-10). Estas proteínas están presentes en todas las especies del complejo M. tuberculosis y estimulan la liberación cuantificable de IFN-γ en la mayoría de las personas con la infección, pero están ausentes en las cepas de la vacuna contra la TB y de la mayoría de las micobacterias no tuberculosas. La medición exacta de la respuesta de IFN-γ con los IGRA exige una muestra de sangre fresca que contenga leucocitos viables.
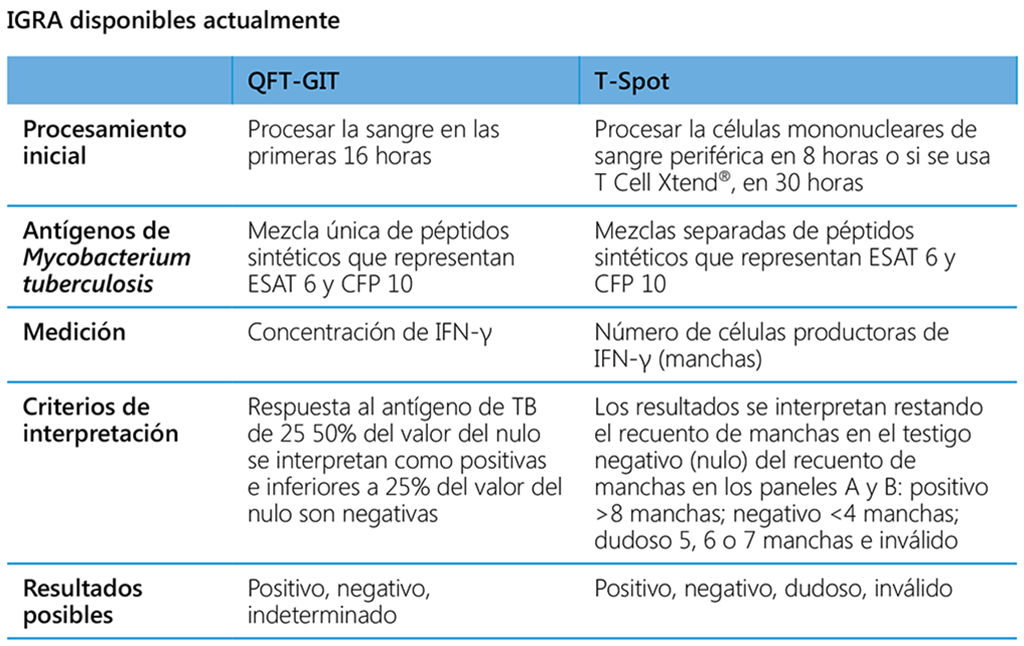
QFT-GIT¹³: En el QFT-GIT los materiales testigo y los antígenos están contenidos en tubos especiales que se utilizan para obtener la muestra de sangre de la prueba, permitiendo así una prueba de sangre fresca más directa. Uno de los tubos contiene heparina y los antígenos de la prueba (mezcla única de 14 péptidos que representan la secuencia completa de aminoácidos de ESAT-6 y CFP-10 y parte de la secuencia de TB7.7) y los otros dos tubos sirven como testigos nulo y positivo. El testigo negativo contiene heparina sola y el testigo positivo contiene heparina, dextrosa y fitohemaglutinina. Se recoge una muestra de sangre (1 ml) en cada uno de los tres tubos, se mezcla con los reactivos que ya están en los tubos y se incuba durante 16 a 24 horas. Se separa el plasma y se determina la concentración plasmática de IFN-γ usando un ELISA sensible. Para interpretar el QFT-GIT, la respuesta se calcula como la diferencia de la concentración de IFN-γ en el plasma de la sangre estimulada con el antígeno (es decir, la mezcla única de péptidos que representan ESAT-6, CFP-10 y TB7.7) menos la concentración de IFN-γ en el plasma de la sangre incubada sin antígeno (es decir, el testigo nulo).
T-spot: Las células mononucleares de sangre periférica se incuban con materiales testigo y dos mezclas de péptidos, uno que representa secuencias que se superponen de la secuencia completa de aminoácidos de ESAT-6 y el otro corresponde a la secuencia completa de aminoácidos de CFP-10. La prueba detecta las células T efectoras sensibilizadas por el M. tuberculosis, que se activan en presencia de los antígenos de CFP-10 y ESAT-6. Las células T efectoras tienen un ciclo de vida corto; sin embargo, su presencia continua indica que el sistema inmunitario de la persona está encontrando un agente patógeno y combatiéndolo en alguna parte del organismo. Por lo tanto, la medición de la presencia de los linfocitos T efectores en una muestra sanguínea indica una infección por TB en curso. La muestra sanguínea se centrifuga y se diluye de manera que se añada un número homogéneo de células mononucleares a cada uno de los cuatro pocillos de la prueba (testigo nulo, panel con antígeno CFP-10, panel con antígeno ESAT-6 y testigo positivo), recubiertos previamente con anticuerpos dirigidos contra el IFN-γ, y se incuban durante 16 a 20 horas. En presencia de linfocitos T efectores activados (personas con la infección), los antígenos específicos de la TB, ESAT-6 y CFP-10, estimulan la liberación de IFN-γ que se fija a los anticuerpos contra el IFN-γ en la base del pocillo. Se lavan los pocillos y se agrega un anticuerpo secundario dirigido contra el IFN-γ. Después de otra etapa de incubación y lavado, se agrega el sustrato. Esto produce manchas en la base del pocillo, donde los linfocitos T habían secretado IFN-γ. Se cuentan las manchas en cada uno de los pocillos para obtener los resultados de la prueba y se compara la diferencia entre las mezclas de antígeno y el testigo nulo. La lectura puede ser manual o mediante un lector de Elispot.
¿Cuáles son las ventajas de los IGRA?
• Requiere una única cita para realizar la prueba. Sin embargo, los resultados solo están disponibles en un plazo de 24 horas, lo que requiere una segunda visita.
• Los errores en la recogida o el transporte de las muestras sanguíneas o en la realización de la prueba pueden disminuir su exactitud.
• Para el tamizaje seriado y periódico de personas que pueden tener una exposición laboral a la TB (como en los programas de vigilancia para trabajadores de salud), los IGRA ofrecen ventajas técnicas, logísticas y posibles ventajas económicas, en comparación con las PT. Los ensayos IGRA no requieren pruebas en dos etapas, porque realizar una prueba no refuerza los resultados ulteriores.
• La Academia Estadounidense de Pediatría revisó sus directrices con el fin de incluir el uso del IGRA hasta los niños de 2 años y sugiere la utilización de IGRA en los niños a partir de los 2 años (152).
¿Cuáles son las desventajas y las limitaciones de los IGRA?
• Las muestras de sangre deben procesarse en las primeras 8-30 horas después de la obtención, mientras los leucocitos son todavía viables.
• Los errores en la recogida o el transporte de las muestras sanguíneas o en la realización de la prueba pueden disminuir su exactitud.
• Las pruebas son costosas.
• Un riesgo mayor de conversión de la prueba, debida a resultados positivos falsos de los IGRA en las pruebas de seguimiento de los trabajadores de salud de bajo riesgo que obtuvieron un resultado negativo en un tamizaje anterior. Una conversión del IGRA se define como un cambio de negativo a positivo en dos años. No se ha demostrado la asociación entre la conversión del IGRA y el riesgo posterior de contraer la enfermedad.
• Datos limitados sobre el uso de los IGRA para pronosticar la progresión hacia la TB activa en el futuro.
• Datos limitados sobre el uso de los IGRA en los menores de 2 años (riesgo mayor de resultados indeterminados), las personas con una exposición reciente a M. tuberculosis, las personas inmunodeprimidas y las pruebas seriadas.
¿Cuáles son los pasos en la realización de un ensayo IGRA?
• Los IGRA deben realizarse e interpretarse según los protocolos establecidos.
• Antes de obtener la muestra sanguínea, se deben adoptar las disposiciones para realizar el IGRA a fin de que la muestra se recoja en los tubos adecuados.
• La muestra de sangre debe extraerse según las instrucciones del fabricante de la prueba.
• Los IGRA deben realizarse e interpretarse según el protocolo nacional establecido.
• Se debe organizar la entrega de la muestra de sangre al laboratorio en el momento que este lo especifique, para garantizar la realización de la prueba mientras los leucocitos son aún viables.
• Programar una cita de seguimiento para que la persona reciba los resultados de la prueba.
• En función de los resultados de la prueba, se propone una evaluación de seguimiento y tratamiento, según sea necesario.
El personal de enfermería y otros trabajadores de salud que han recibido capacitación en flebotomía pueden solicitar un IGRA y entregar el resultado a la persona examinada, explicándole su importancia.
¿Cómo interpretar los resultados de los IGRA?
Las interpretaciones del IGRA se basan en la cantidad de IFN-γ liberado o en el número de células que liberan IFN-γ. Se debe informar tanto la interpretación cualitativa habitual de la prueba (resultado positivo, negativo o indeterminado) como la medición cuantitativa del análisis (nulo, TB y las concentraciones de mitógeno o los recuentos de manchas). Esto permitirá una evaluación más rigurosa de los resultados y facilitará una mejor comprensión del resultado de la prueba. Al igual que las PT, los IGRA deben usarse como una ayuda al diagnóstico de la infección por M. tuberculosis. Un resultado positivo de la prueba indica que la infección por M. tuberculosis es probable y un resultado negativo significa que la infección es improbable. Un resultado indeterminado indica una probabilidad incierta de infección por M. tuberculosis. Un resultado dudoso de la prueba (solo T-Spot) también indica una probabilidad incierta de infección por M. tuberculosis.
En el caso de las personas sanas con una probabilidad baja, tanto de infección por TB como de progresión hacia la TB activa, un solo resultado positivo del IGRA o de la PT no debe tomarse como una prueba fiable de infección por M. tuberculosis. Debido a la baja probabilidad de infección, es más probable un resultado positivo falso. En estas circunstancias, la probabilidad de infección por M. tuberculosis y de progresión hacia la enfermedad se debe evaluar de nuevo y es necesario confirmar los resultados de las pruebas iniciales. Se puede considerar caso por caso la repetición de las pruebas, ya sea con la prueba inicial o una prueba diferente o también se puede suponer que el resultado inicial es un positivo falso, sin realizar pruebas adicionales.
¹³ Please note that the guidance covers only currently recommended IGRA tests in the 2020 WHO guidelines for programmatic management of TPT, which are based on reviews done in 2017. The manufacturers of QFT-GIT plan to phase this test out and substitute with the 4 tube QFT plus test.
 Reacción
Reacción