Enlaces transversales de Book para 4.4.1 Decision pathway for Algorithm 4
- Obtener una muestra de buena calidad y transportarla al laboratorio para realizar las pruebas moleculares o fenotípicas de resistencia a la INH.
- Las pruebas moleculares y fenotípicas se pueden realizar en diferentes laboratorios. Si se llevan a cabo ambas pruebas, iniciarlas de manera simultánea; sin esperar los resultados de una prueba antes de iniciar la otra.
- Las PSF molecular y fenotípica pueden realizarse a partir de una muestra (PSF directa) o usando micobacterias recuperadas del cultivo (PSF indirecta). La PSF fenotípica directa aporta los resultados en un tiempo mucho más corto, pero se puede preferir la PSF fenotípica indirecta por razones técnicas.
- Se prefiere una prueba molecular rápida. En la actualidad, la LPA-PL es la única prueba molecular rápida aprobada por la OMS para detectar la resistencia a la INH. La secuenciación de ADN ha resultado útil en muchos casos, pero la OMS todavía no ha evaluado este método.
- El resultado de la PSF fenotípica para INH a partir del cultivo necesita de 3 a 8 semanas. La PSF fenotípica puede ser útil para evaluar a los pacientes con un resultado negativo de la LPA-PL, sobre todo en las poblaciones con una probabilidad preanálisis alta de resistencia a INH.
- Interpretar los resultados de la LPA-PL según se describe en la orientación sobre LPA para la detección de la TB farmacorresistente y su interpretación y comunicación de resultados, dirigida al personal clínico y de laboratorio
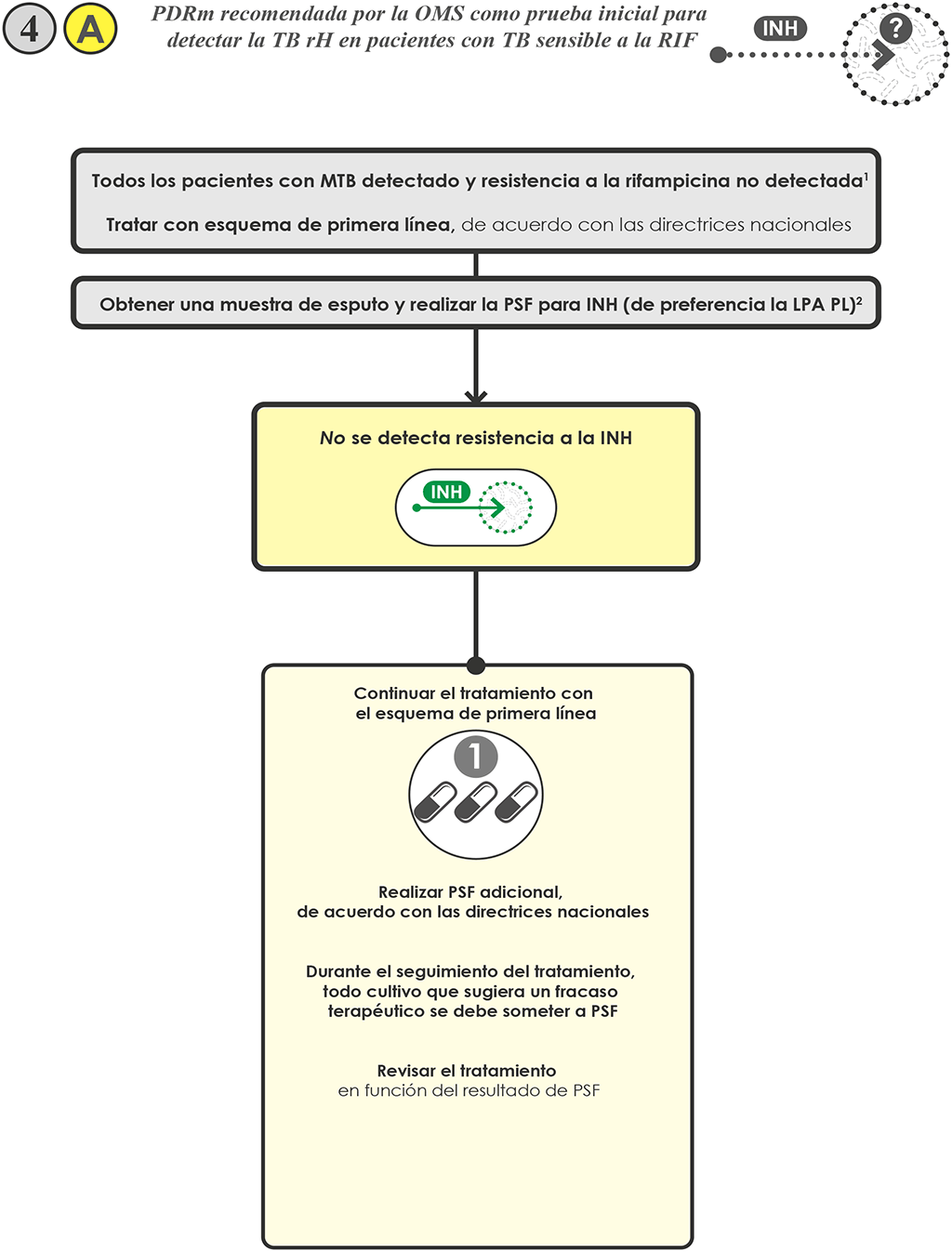
- Si no se detecta resistencia a la INH 4 A, continuar el tratamiento con un esquema de primera línea, de acuerdo con las directrices nacionales:
- Realizar una PSF adicional según con las directrices nacionales.
- Se puede solicitar una PSF adicional molecular o fenotípica para resistencia a la INH, si se considera que el paciente tiene riesgo de TB-rH, a pesar del resultado de la LPA-PL. Se han observado resultados falsos de sensibilidad a la INH con la LPA-PL en cerca de 10% de los casos de TB resistentes a la INH, examinados en diversos entornos epidemiológicos. Comparados con las PSF fenotípicas, las LPA-PL tienen una sensibilidad combinada cercana a 90% y una especificidad combinada alrededor de 99% para detectar la resistencia a la INH (9):
- Si se detecta resistencia a la INH 4 B y C :
- Iniciar tratamiento con un esquema para la TB-rH (33):
- No hay evidencia clara que indique que al agregar la INH en las dosis usuales se añadan ventajas o daños a los pacientes. Por razones de comodidad para el paciente y facilidad de administración, se pueden usar comprimidos en dosis fijas combinadas de cuatro fármacos INH/RIF/EMB/PZA (HREZ) con el objeto de administrar el esquema para la TB-rH junto con la LFX.
- Según evidencia reciente, los pacientes infectados con cepas que portan solo mutaciones en la región del promotor de inhA y que se asocian a con aumentos moderados de la CIM, se pueden beneficiar con el tratamiento con INH en dosis altas (34). Por lo tanto, se puede considerar aumentar la INH hasta una dosis máxima de 15 mg/kg diarios para administrarla con el esquema para TB-rH para estos aislamientos. El valor agregado de la isoniacida en el esquema, incluso cuando se usa en la dosis más alta, disminuye a medida que la CIM aumenta más.
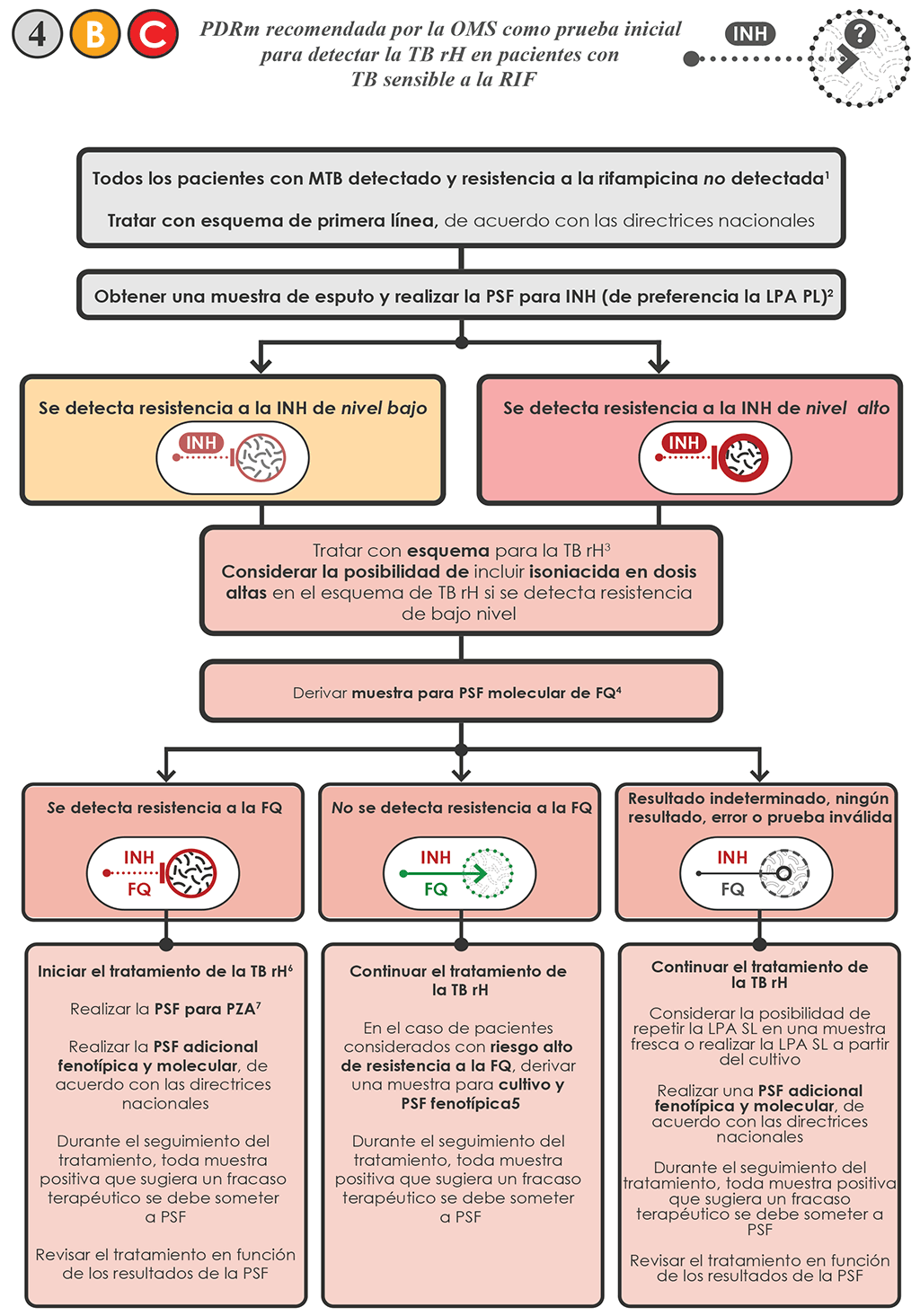
- Derivar una muestra de cada paciente con TB-rH confirmada por el laboratorio para realizar la PSF molecular (por ejemplo, LPA-SL) o PSF fenotípica para LFX.
- Se prefiere el análisis molecular rápido de resistencia a la FQ. En la actualidad, la LPA-SL es la única prueba molecular rápida aprobada por la OMS para la resistencia a la FQ.
- La precisión diagnóstica de la LPA-SL es equivalente cuando se realiza en forma directa del esputo o en los aislados de cultivo. La LPA-SL se puede utilizar en las muestras con baciloscopia positiva o negativa, aunque se observan tasas más altas de resultados indeterminados en las muestras con baciloscopia negativa.
- La utilización de la LPA-SL es apropiada a nivel del laboratorio central o el laboratorio nacional de referencia. También puede utilizarse a nivel regional, cuando se cuenta con la infraestructura, los recursos humanos y los sistemas de garantía de la calidad apropiados. Al introducir la LPA-SL se debe garantizar la disponibilidad de un sistema fiable de transporte de muestras y un mecanismo eficiente de comunicación de los resultados.
- Cuando se utiliza la LPA-SL directo en muestras de esputo de pacientes con TB-MDR/RR, se detecta 86% de los pacientes con resistencia a la FQ (10).
- Pese a la especificidad y la sensibilidad adecuadas de la LPA SL en la detección de la resistencia a la FQ, se necesitan el cultivo y la PSF fenotípica para descartar plenamente la resistencia a cada FQ individualmente. La PSF fenotípica puede necesitarse sobre todo en los entornos con una probabilidad preanálisis alta de resistencia a la LFX, con el fin de excluir la resistencia cuando la LPA-SL no detecta mutaciones asociadas con la resistencia.
- Si no se detecta resistencia a la LFX, continuar el tratamiento con el esquema de TB rH que contiene LFX.
- Si se detecta resistencia a la LFX:
- Descontinuar el uso de LFX y cambiar por un esquema de 6 meses con (INH)/ RIF/EMB/PZA (es decir, 6(H) REZ, donde “(H)” indica que la INH es optativa) o un esquema individualizado para la TB rH.
- Derivar una muestra para realizar la PSF de PZA si se cuenta en el país con una PSF fiable para PZA. Las opciones incluyen la PSF fenotípica en el sistema MGIT y la secuenciación de pncA (Sanger o SNG). Para más detalles, véase el manual técnico de la OMS para la PSF de los fármacos utilizados en el tratamiento de la TB
- Se prefiere el análisis molecular rápido de resistencia a la FQ. En la actualidad, la LPA-SL es la única prueba molecular rápida aprobada por la OMS para la resistencia a la FQ.
- Si no se detecta resistencia a la PZA o si no se cuenta con la PSF de PZA, continuar el tratamiento con el esquema diseñado a partir de los resultados de la LPA-SL.
- Si se detecta resistencia a la PZA, puede ser necesario diseñar esquemas de tratamiento apropiados para cada caso, sobre todo cuando se detectan resistencias tanto a la FQ como a la PZA.
- Iniciar tratamiento con un esquema para la TB-rH (33):
- Si el resultado de INH es no interpretable o inválido, repetir la LPA-PL con una muestra fresca. Pensar en realizar un cultivo y la PSF molecular o fenotípica para INH con el aislamiento, si se considera que el paciente tiene riesgo de TB-rH.
- En todos los pacientes, el seguimiento del tratamiento debe incluir la obtención de muestras para el cultivo, según se describe en las directrices de la OMS. Todo cultivo positivo que sugiera el fracaso terapéutico se debe someter a la PSF fenotípica y molecular, si están disponibles. Como mínimo, la PSF debe incluir el examen de la resistencia a la INH y la RIF en los pacientes que reciben esquemas de primera línea y para la RIF, las FQ y la PZA (si están disponibles) en los pacientes que reciben esquemas para TB-rH. El esquema de tratamiento debe modificarse según sea necesario, en función de los resultados de la PSF.
Interpretación de los resultados discordantes
Este algoritmo se basa en el examen de una muestra con una PDRm para detectar el complejo M. tuberculosis y evaluar la sensibilidad a la RIF y la prueba de seguimiento con LPA-PL, en primer lugar para detectar resistencia a la INH, aunque también suministra información sobre la detección de MTB y la resistencia a la RIF. En ocasiones los resultados pueden ser discordantes. Cada resultado discordante deberá investigarse caso por caso. A continuación se describen las consideraciones generales.
- Resultado “MTB detectado” en la PDRm (por ejemplo, Xpert Ultra) y “MTB no detectado o no interpretable” en la LPA-PL de seguimiento.
- Las PDRm tienen un umbral de detección más bajo que la LPA-PL; por lo tanto, la LPA-PL puede fallar en la detección de la TB en muestras positivas con la PDR que contienen pocos bacilos. Por ejemplo, se estima que cerca de 80% de las muestras detectadas por la prueba Xpert MTB MTB/RIF generarán un resultado interpretable en la LPA-PL.
- Debe usarse el resultado de la PDRm para orientar las decisiones terapéuticas, en espera de la prueba adicional.
- Las medidas de seguimiento pueden incluir obtener una muestra para cultivo y una prueba molecular o fenotípica del aislamiento recuperado y evaluar la posibilidad de un error de laboratorio o de transcripción.
- Resultado “MTB detectado, no se detecta resistencia a la RIF” en la PDRm y “resistencia la RIF” en la LPA PL.
- Las decisiones terapéuticas deben basarse en el resultado de la LPA-PL.
- Se prevé que este resultado sea raro porque ambos análisis investigan la misma región del gen rpoB. Ha habido informes discordantes de sensibilidad a la RIF en la PDRm y resistencia a la RIF en la LPA-PL, pero los datos son escasos para evaluar la frecuencia.
- La LPA-PL es más sensible para detectar la resistencia a la RIF que la PDRm en poblaciones de micobacterias heterorresistentes (mezclas de bacterias sensibles y resistentes), cuando la resistencia se detecta mediante hibridación a una sonda MUT que podría dar lugar a esta discordancia.
- Las medidas de seguimiento pueden incluir secuenciación del ADN, PSF fenotípica y evaluar la posibilidad de un error de laboratorio o de transcripción.
Consideraciones para la utilización de la LPA-PL en la detección de la resistencia a la INH
Las LPA PL son una familia de análisis de ADN en tiras aprobados por la OMS, que determinan el tipo de farmacorresistencia de MTB mediante el patrón de fijación de los amplicones (productos de amplificación de ADN) a sondas que se dirigen a las mutaciones más frecuentes que confieren resistencia a los principales fármacos de primera línea (INH y RIF) y sondas que se dirigen a la secuencia de ADN de tipo salvaje correspondiente (9,10). Las mutaciones se detectan mediante la fijación de las sondas específicas que se dirigen a las mutaciones que ocurren con más frecuencia (sondas MUT) o se infieren ante la ausencia de hibridación de los amplicones a las sondas de tipo silvestre correspondientes.
Según la región específica del genoma que examina la sonda de la LPA-PL, se recomiendan o se sugieren como una opción, una o varias medidas diagnósticas consecutivas, con el fin de orientar mejor el esquema de tratamiento a partir de la detección de mutaciones específicas (27). Si se utiliza la secuenciación para detectar la mutación específica, se puede consultar la orientación sobre la interpretación de las mutaciones individuales de inhA o katG en la guía técnica de la OMS correspondiente (31). La PSF fenotípica o la determinación de las CIM también pueden suministrar información importante acerca de la resistencia a la INH (por ejemplo, de bajo nivel o de alto nivel).
- Si la resistencia se infiere por la ausencia de fijación de los amplicones a las sondas de tipo salvaje en la región katG (es decir, que no se evidencian una o varias sondas de tipo salvaje), se sugiere secuenciar el gen katG como una opción para detectar la mutación específica.
- Si se detectan mutaciones asociadas con un aumento leve de la CIM, se sugiere secuenciar la región que codifica el gen inhA y el katG como una opción para confirmar la mutación.
- Si se infieren mutaciones asociadas con un aumento leve de la CIM por la ausencia de fijación de los amplicones a las sondas de tipo salvaje en la región del promotor de inhA (y no se detecta ninguna mutación en la región blanco del gen katG), se recomienda repetir la prueba para confirmar el resultado. Entre las medias diagnósticas consecutivas optativas se cuentan la secuenciación del promotor de inhA con el fin de detectar la mutación específica, o realizar la PSF fenotípica para INH, o determinar la CIM de INH.
- Con fines de registro y notificación los resultados de la LPA PL “se detecta resistencia” y “se infiere resistencia” se deben considerar como resistentes.
Introducción de un nuevo algoritmo diagnóstico
Las modificaciones a los algoritmos diagnósticos solo se deben introducir después de una evaluación, examen y aprobación formales por parte de funcionarios del Ministerio de Salud, el programa nacional de tuberculosis y el laboratorio nacional de referencia. A menudo, los grupos temáticos de trabajo designados a nivel nacional se ocupan de evaluar las tecnologías nuevas y elaborar planes de implementación, que normalmente incluyen la revisión de los algoritmos vigentes. Estos grupos están conformados por funcionarios locales del ministerio, asociados en la implementación, la sociedad civil y profesionales (de laboratorio y médicos), quienes decidirán la utilización y ubicación óptimas de la nueva tecnología en la estructura de la red actual. Los siguientes aspectos se deben tener en cuenta cuando se diseñan o se examinan los algoritmos para las pruebas en diferentes niveles de la red de laboratorios:
- las pruebas diagnósticas específicas en uso o cuyo uso futuro se examina;
- si las pruebas están recomendadas por la OMS y con qué finalidad;
- la capacidad de obtención de muestras que exige la prueba;
- qué pruebas adicionales se recomiendan para dar seguimiento a los resultados de las pruebas nuevas;
- la capacidad actual y planificada de los laboratorios del país, la infraestructura de laboratorio y la disponibilidad de personal competente para realizar las pruebas;
- la adecuación de los sistemas de obtención y transporte de las muestras;
- la capacidad de los servicios clínicos para ofrecer diagnóstico y tratamiento;
- los fármacos empleados en el tratamiento de la TB y la TB-DR en el país; y
- las características (grupos de riesgo) de la población atendida, que deben derivarse de estudios poblacionales (si existen), incluida la proporción de personas con TB-DR, infección por el VIH y personas con TB extrapulmonar y la proporción de TB en los niños.
Los algoritmos se deben diseñar para utilizarlos en los servicios y las redes de laboratorio existentes, de manera que las muestras puedan derivarse al nivel apropiado para realizar las pruebas que no están disponibles en laboratorios de nivel periférico. Estas derivaciones adquieren una importancia especial cuando se evalúan personas con TB DR o TB asociada con el VIH, se investigan niños con TB o personas con enfermedad extrapulmonar.
Dado que los factores de riesgo de contraer la TB y la TB-DR varían mucho entre los distintos países, es esencial evaluar con cuidado los riesgos a escala local y nacional. Los algoritmos de pruebas para los pacientes con presunción de TB-DR dependen de las características epidemiológicas locales de la TB, las políticas locales de tratamiento, la capacidad existente en materia de laboratorio, los mecanismos de derivación y transporte de las muestras, y los recursos humanos y económicos.
 Reacción
Reacción