Enlaces transversales de Book para 6.2.2 Medicines used in longer MDR-TB treatment regimens
La clasificación de los medicamentos utilizados en los esquemas terapéuticos para la TB-RR/MDR se modificó tras la actualización de las directrices de la OMS sobre el tratamiento de la TB-DR en el 2018, basada en la evidencia. Los medicamentos contra la TB que se emplean para el tratamiento de la TB-RR/MDR se organizan en tres grupos: A, B y C (cuadro 6.1) (1). Esta clasificación se basa en las clases farmacológicas y en el nivel de certeza en la evidencia sobre su eficacia y seguridad (es decir, el equilibrio entre los beneficios que brindan y el riesgo de daño). Los datos analizados se referían principalmente a pacientes adultos que recibieron diversos esquemas en los últimos años. Los grupos A-C comprenden los medicamentos que deberán utilizarse para configurar los esquemas alargados para la TB-MDR. La OMS considera que, en condiciones programáticas, solo estos medicamentos (de los grupos A-C) deben figurar en los esquemas alargados de tratamiento de la TB-MDR.
Además de los fármacos de los grupos A-C, también se examinó la posible función del ácido clavulánico y de la isoniacida en dosis altas (véase el apartado “Otros medicamentos” en esta sección).
Las diferencias más notables entre la clasificación de los componentes para los esquemas alargados empleada antes del 2018 y las directrices actuales son una mayor prioridad de la bedaquilina, el linezolid, la clofazimina y la cicloserina o terizidona; la inclusión del delamanid en el grupo C; y una reducción de la prioridad de la pirazinamida, la amikacina, la estreptomicina, la etionamida o protionamida y el ácido paraaminosalicílico en relación con otras opciones terapéuticas. Varios fármacos que figuraban anteriormente en esos grupos ya no están incluidos por las siguientes razones:
- ya no se recomiendan (por ejemplo, la ofloxacina, la capreomicina y la kanamicina);
- rara vez se usa en los esquemas alargados (por ejemplo, la isoniacida en dosis altas); o
- son fármacos auxiliares que no deben utilizarse solos (por ejemplo, el ácido clavulánico se utiliza únicamente en combinación con los carbapenémicos).
La clasificación facilita diseñar el esquema terapéutico para los pacientes con TB-DR que no reúnen los requisitos para el esquema de BPaLM/BPaL o el esquema totalmente oral de 9 meses. En el cuadro 6.1 se resumen los pasos generales para integrar los medicamentos en un esquema alargado para la TB-MDR, de conformidad con la orientación más reciente de la OMS, con más detalles sobre algunas de las situaciones y los subgrupos de pacientes más comunes que pueden encontrar los PNT y el personal médico.
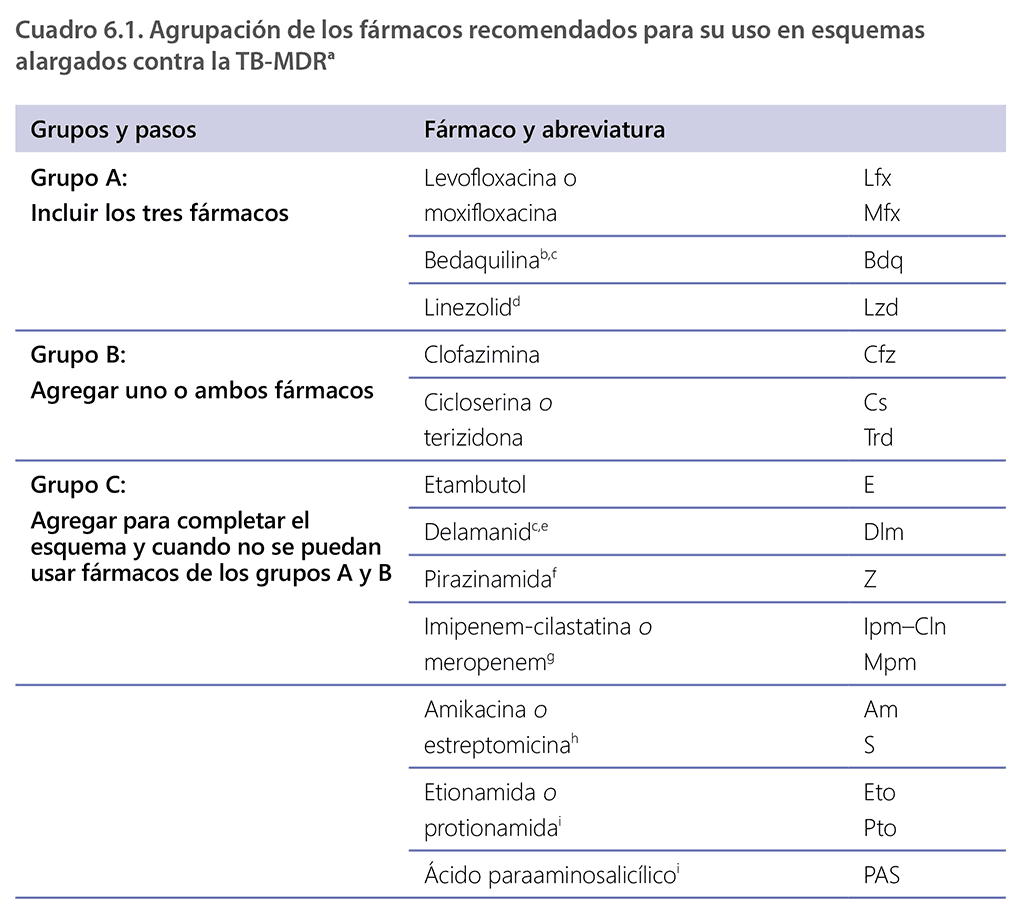
El propósito de este cuadro es orientar el diseño de esquemas alargados e individualizados contra la TB-MDR. Los fármacos del grupo C se clasifican por orden decreciente de preferencia habitual de uso, sujeto a otras consideraciones. El metanálisis de datos de pacientes individuales del 2018 relativo a esquemas alargados no incluyó a pacientes tratados con tioacetazona ni a pacientes suficientes con isoniacida en dosis altas para que el análisis fuera significativo. No fue posible formular ninguna recomendación sobre la perclozona, el interferón γ o el sutezolid, debido a la falta de datos definitivos sobre el resultado del tratamiento obtenidos en estudios adecuados en pacientes (1).
b Se suele administrar la bedaquilina en dosis de 400 mg por vía oral una vez al día durante las primeras 2 semanas, seguidos por 200 mg por vía oral tres veces por semana durante 22 semanas (duración total de 24 semanas). Como resultado de múltiples revisiones, y a medida que se ha ido disponiendo de nuevos datos, el uso de la bedaquilina y del delamanid ya no está restringido por la edad del paciente. La evidencia sobre la seguridad y la eficacia del uso de la bedaquilina durante más de 6 meses fue insuficiente para la revisión del 2018. Por consiguiente, el uso de la bedaquilina durante más de 6 meses se adoptó de conformidad con las mejores prácticas para el uso de medicamentos extraoficial o “en indicaciones no autorizadas” (66). En el 2019, el grupo de elaboración de las directrices contó con nueva evidencia sobre el perfil de seguridad de la bedaquilina utilizada durante más de 6 meses, pero no pudo evaluar el impacto de su uso prolongado en la eficacia, debido a lo limitado de la evidencia y a la posible confusión residual de los datos. Sin embargo, la evidencia confirma que es seguro utilizar la bedaquilina durante más de 6 meses en pacientes sometidos a programas apropiados de vigilancia al inicio y durante el seguimiento. El uso de la bedaquilina durante más de 6 meses sigue siendo extraoficial y, a este respecto, siguen siendo pertinentes las mejores prácticas para el uso en indicaciones no autorizadas.
c La evidencia sobre el uso simultáneo de bedaquilina y delamanid fue insuficiente para la revisión del 2018. En el 2019, el grupo de elaboración de las directrices contó con nueva evidencia sobre el uso simultáneo de bedaquilina y delamanid. Con respecto a la seguridad, el grupo de elaboración de las directrices llegó a la conclusión de que los datos no parecen indicar ningún otro problema de seguridad relativo al uso simultáneo de bedaquilina y delamanid. Entre el 2020 y el 2022 se agregó más evidencia al respecto (67). Ambos fármacos pueden utilizarse simultáneamente en los pacientes que tienen pocas opciones terapéuticas aparte de estos fármacos, siempre que se haga un seguimiento suficiente (que incluya un ECG y la vigilancia de los electrolitos al inicio y durante el tratamiento). El grupo de elaboración de las directrices examinó los datos sobre la eficacia del uso simultáneo de bedaquilina y delamanid en el 2019; sin embargo, debido a lo limitado de la evidencia y a la posible confusión residual de los datos, no pudo formular una recomendación sobre la eficacia (1).
d Se demostró que el uso del linezolid durante al menos 6 meses aumenta la eficacia, aunque la toxicidad puede limitar su uso. Según indicó el análisis, el uso de linezolid durante todo el tratamiento optimizaría su efecto (alrededor del 70% de los pacientes tratados con linezolid de los cuales se disponía de datos lo recibieron durante más de 6 meses, y el 30% durante 18 meses o durante todo el tratamiento). No se pudieron deducir factores predictivos de la suspensión prematura del tratamiento con linezolid a partir del subanálisis de datos de pacientes individuales.
e La evidencia sobre la seguridad y la eficacia del uso del delamanid durante más de 6 meses fue insuficiente para la revisión. El uso del delamanid más allá de estos límites debería seguir las mejores prácticas para el uso en “indicaciones no autorizadas” (66). Como resultado de múltiples revisiones, y a medida que se ha ido disponiendo de nuevos datos, el uso del delamanid ya no está restringido por la edad del paciente.
f La pirazinamida se cuenta como un fármaco eficaz únicamente cuando los resultados de las pruebas de sensibilidad a fármacos confirman la sensibilidad.
g Todas las dosis de imipenem-cilastatina o de meropenem deben ir precedidas 30 a 60 minutos antes por la administración de ácido clavulánico por vía oral, que solo está disponible en formulaciones combinadas con amoxicilina. La combinación de amoxicilina y ácido clavulánico no se cuenta como un medicamento eficaz adicional contra la TB, ni debe usarse sin administrar imipenem-cilastatina o meropenem.
h Solo se considerará el uso de la amikacina y la estreptomicina si los resultados de las pruebas de sensibilidad a fármacos confirman la sensibilidad y si se puede garantizar el seguimiento de la pérdida de audición mediante audiometrías de gran calidad. Únicamente se planteará el uso de la estreptomicina si no se puede utilizar la amikacina (es decir, si no se dispone de ella o en caso de resistencia documentada) y si los resultados de las pruebas de sensibilidad a fármacos confirman la sensibilidad (la resistencia a la estreptomicina no se puede detectar mediante pruebas moleculares con sondas lineales de segunda línea, y es necesario realizar pruebas fenotípicas de sensibilidad a fármacos). Ya no se recomienda usar la kanamicina ni la capreomicina en los esquemas contra la TB-MDR.
i Estos fármacos fueron eficaces solo en esquemas sin bedaquilina, linezolid, clofazimina o delamanid y, por lo tanto, se proponen únicamente cuando no haya otras opciones para configurar un esquema.
Grupo A
El grupo A comprende las fluoroquinolonas (levofloxacina y moxifloxacina), la bedaquilina y el linezolid. Según la evidencia examinada en el 2018 para las directrices de la OMS, se observó que estos medicamentos eran muy eficaces para mejorar los resultados del tratamiento y reducir las muertes (1), y se recomienda firmemente que se incluyan en todos los esquemas alargados para la TB-MDR y se utilicen para todos los pacientes con TB-RR/MDR que reúnan los requisitos para seguir esquemas alargados, a menos que haya un problema de toxicidad o farmacorresistencia.
Levofloxacina y moxifloxacina
La levofloxacina y la moxifloxacina son fluoroquinolonas de última generación; según el metanálisis que sirvió de base para las directrices de la OMS (actualización del 2018), su uso dio lugar a un riesgo significativamente menor de fracaso del tratamiento o recaída y de muerte (1, 11, 68, 69). La levofloxacina y la moxifloxacina parecen tener la misma eficacia en los pacientes con TB sensible a las fluoroquinolonas que reciben los esquemas alargados, y puede considerarse cualquiera de ellas para el tratamiento de la TB-RR/MDR en el que se emplean dichos esquemas. La ciprofloxacina y la ofloxacina son menos eficaces en el tratamiento de la TB-MDR y ya no se recomiendan.
Se cuenta con pruebas rápidas de sensibilidad a fármacos fiables para la levofloxacina y la moxifloxacina, como Xpert® MTB/XDR y pruebas con sondas lineales de segunda línea. No todas las mutaciones puntuales presentan el mismo perfil de resistencia. A pesar de que algunas mutaciones (como gyrA D94N o D94Y) dan como resultado concentraciones inhibitorias mínimas (CIM) altas de manera sostenida, la mayoría de las mutaciones entrañan todo un intervalo de resistencia fenotípica, que puede superar la concentración crítica y el umbral clínico. Por lo tanto, una vez que se haya detectado resistencia a las fluoroquinolonas por métodos moleculares y se haya iniciado el tratamiento, se puede utilizar un método fenotípico como prueba de referencia para distinguir entre mutaciones de resistencia de alto nivel (por arriba del umbral clínico) y de bajo nivel (por arriba de la concentración crítica y por abajo del umbral clínico), lo que podría permitir el uso de una dosis alta de fluoroquinolonas. Cuando se detecten estas mutaciones, la composición del esquema alargado se debe reevaluar en función de los resultados de las pruebas fenotípicas de sensibilidad a fármacos en el umbral clínico (70).
No se debe usar moxifloxacina si las pruebas de sensibilidad confirman un alto nivel de resistencia a esta o si los antecedentes del paciente indican que no ha sido eficaz (por ejemplo, si se usó durante más de 15-30 días en un esquema que fracasó). Se está trabajando para optimizar el uso de moxifloxacina en relación con la secuenciación, la concentración crítica en las pruebas fenotípicas de sensibilidad y la correlación clínica (70-72).
Bedaquilina
En el metanálisis de datos de pacientes individuales empleado como evidencia para fundamentar las directrices de la OMS, la utilización de bedaquilina dio lugar a un número significativamente menor de episodios de fracaso del tratamiento, recaída y muerte (1). Cada vez hay más experiencia sobre su uso en población infantil y adolescente, personas mayores, pacientes con enfermedad por TB extrapulmonar y personas con infección por el VIH (73, 74). En la actualidad, no hay restricciones al uso de la bedaquilina por la edad, ni siquiera en los esquemas alargados (47).
Los análisis de los datos de los estudios observacionales destacaron la mejor supervivencia de los pacientes tratados con esquemas que contenían bedaquilina (47) y el perfil de seguridad favorable de este fármaco al utilizarlo junto con otros medicamentos contra la TB, entre ellos medicamentos que prolongan el intervalo QT (por ejemplo, moxifloxacina, clofazimina y delamanid) (75-80). El examen reciente de los datos para las directrices unificadas de la OMS (1) no puso de manifiesto ningún otro motivo de preocupación en cuanto a la seguridad del uso de la bedaquilina durante más de 6 meses, simultáneamente con delamanid, ni tampoco en el embarazo (77). Los datos examinados indicaron que el uso simultáneo de bedaquilina y delamanid no aumenta el riesgo de una prolongación del intervalo QT de importancia clínica (81).
Está surgiendo cierta evidencia no concluyente; por ejemplo, algunos datos publicados sobre el rápido surgimiento de resistencia a la bedaquilina en entornos donde se la utiliza parecen indicar que tal vez este sea un fármaco de baja barrera genética (es decir, que hace que surja resistencia rápidamente) como resultado de mutaciones naturales frecuentes. También hay que tener presente su larga semivida (5,5 meses), que puede llevar a que funcione como monoterapia en pacientes con quienes se pierde contacto en el seguimiento. Se deben realizar pruebas de resistencia a las fluoroquinolonas para prevenir la aparición de resistencia a la bedaquilina, y cuando sea posible, es preciso vigilar los niveles de resistencia. La bedaquilina presenta resistencia cruzada con la clofazimina en casos de mutación del gen Rv0678 (que produce una intensificación de las bombas de salida) y del gen pepQ. Puede aparecer resistencia espontáneamente, incluso sin exposición previa a la bedaquilina o la clofazimina (4,1% en algunos estudios) (82, 83). Las mutaciones en el gen atp-E pueden conferir un alto nivel de resistencia a la bedaquilina.
Linezolid
Se ha demostrado la actividad del linezolid contra la TB in vitro y en estudios con animales, y su eficacia en el ser humano se demostró en el metanálisis realizado para fundamentar las directrices de la OMS, así como en varios ensayos recientes en pacientes con TB-XDR (1, 84-88).
El linezolid tiene una toxicidad considerable, lo que requiere un seguimiento estrecho para detectar posibles signos de mielosupresión y neuropatías. El metanálisis del 2018 de los datos de pacientes individuales para fundamentar las directrices de la OMS incluyó información sobre más de 300 pacientes que recibieron tratamiento con linezolid durante al menos 1 mes, en su mayoría con 600 mg diarios. Alrededor del 30% solo recibieron el linezolid durante 1-6 meses, pero más del 30% lo recibieron durante más de 18 meses, y estos pacientes tuvieron la menor frecuencia de fracaso del tratamiento, pérdida de contacto durante el seguimiento y muerte. Ese análisis también indicó que la duración óptima de uso sería de unos 20 meses, lo que corresponde a la duración total habitual de un esquema alargado contra la TB-MDR. Sin embargo, el análisis no tuvo en cuenta el sesgo de supervivencia, que hace que sea más probable que los pacientes que completan todo el tratamiento tengan un resultado satisfactorio, dado que las muertes y las pérdidas de contacto durante el seguimiento se producen antes (1, 89).
Según la evidencia de las directrices unificadas de la OMS (1), se recomienda utilizar el linezolid durante todo el tiempo que se tolere. Los resultados tal vez sean mejores si se emplea el linezolid a lo largo de todo el tratamiento. Sin embargo, probablemente aporte su mayor efecto adicional (incluida la protección de otros medicamentos de segunda línea frente a la farmacorresistencia) durante los primeros meses de tratamiento, cuando la carga bacilar es más elevada (90). Si aparecen efectos adversos, se debe reducir la dosis de linezolid, o sustituirlo por otro fármaco bactericida (17).
El linezolid no se ve afectado ni es metabolizado por el citocromo p450; sin embargo, es un inhibidor de la monoaminooxidasa, lo que produce un aumento en las concentraciones de serotonina y tiramina. Cuando se administra linezolid concomitantemente con otros inhibidores de la monoaminooxidasa que se usan a menudo en la práctica clínica en pacientes con TB (por ejemplo, antidepresivos, analgésicos opioides como el tramadol, medicamentos para el resfriado común o antitusivos como el dextrometorfano), se puede producir un síndrome serotoninérgico, el cual puede ser grave y potencialmente mortal (91).
Grupo B
Los medicamentos del grupo B son la clofazimina y la cicloserina o la terizidona. En la evidencia que se examinó en el 2018 para fundamentar las directrices de la OMS se observó que fueron eficaces para mejorar los resultados del tratamiento, pero limitadas para reducir las muertes (1). Se pueden agregar una o dos de ellas para asegurarse de que un esquema alargado comience con un mínimo de cuatro fármacos eficaces.
Clofazimina
La clofazimina es un medicamento contra la lepra con actividad in vitro demostrada contra M. tuberculosis y que se ha utilizado como fármaco de segunda línea contra la TB durante varios años. El metanálisis realizado para las directrices de la OMS confirmó la evidencia sobre el perfil de eficacia y seguridad de la clofazimina (1). Cuando se utiliza con fármacos que prolongan el intervalo QT (por ejemplo, bedaquilina, fluoroquinolonas y delamanid), la clofazimina puede incrementar dicha prolongación. Debe realizarse un seguimiento electrocardiográfico cuando se utiliza con bedaquilina, o si también forman parte del esquema varios medicamentos que prolonguen el intervalo QT. De ser posible, se deben evitar los medicamentos que no sean contra la TB y que causen prolongación del intervalo QT.
Los eventos adversos más comunes asociados a la clofazimina son una coloración parda anaranjada o roja violácea de la piel, las conjuntivas, las córneas y los líquidos corporales; piel seca, prurito, erupción, ictiosis y xerosis; intolerancia gastrointestinal; y fotosensibilidad. Debe informarse detalladamente a los pacientes desde el principio sobre los cambios reversibles del color de la piel que se producen en la mayoría de quienes emplean este medicamento. El tono pardo anaranjado que adquiere la piel es reversible unos meses después de suspender el fármaco (o a veces más tarde), y no se considera una alteración peligrosa. Estos cambios en la piel pueden ser bastante preocupantes para los pacientes y es necesario tranquilizarles. La clofazimina se puede usar durante el embarazo o la lactancia, debido a la escasez de datos y a la pigmentación del lactante si la madre lo emplea durante la lactancia natural. La clofazimina se metaboliza parcialmente en el hígado; por lo tanto, en los pacientes con insuficiencia hepática grave hay que administrarla con cautela o ajustar la dosis.
Cicloserina
La cicloserina es un fármaco bacteriostático que inhibe la síntesis de la pared celular y no tiene resistencia cruzada conocida con otros medicamentos contra la TB. La terizidona (compuesta de dos moléculas de cicloserina) se puede usar en lugar de cicloserina, y ambas se consideran intercambiables. Debido a las dificultades para interpretar las pruebas de sensibilidad (no hay una prueba de sensibilidad genotípica o fenotípica confiable para estos fármacos), solo debe considerarse la utilización de cicloserina o terizidona cuando se cumplan otros criterios de probabilidad de eficacia; por ejemplo, que haya evidencia fiable sobre los niveles de farmacorresistencia en la población e información sobre el uso previo de cicloserina o terizidona por el paciente, basada en una anamnesis clínica fiable (sección 3.1). Debe informarse detenidamente a los pacientes sobre los posibles eventos adversos de la cicloserina. Un evento adverso importante es la toxicidad para el sistema nervioso central, que se manifiesta como incapacidad para concentrarse, depresión, cambios en la conducta (por ejemplo, violencia y agresividad o ideas suicidas), psicosis franca, convulsiones y letargo
La cicloserina puede exacerbar las afecciones neurológicas o psiquiátricas preexistentes. Entre los pacientes con MDR/RR-TB no son raras las situaciones de estigmatización, pobreza extrema y vulnerabilidad social, que afectan la salud mental. La depresión y la ansiedad también son muy prevalentes y pueden derivar en un peor pronóstico y en la pérdida de contacto en el seguimiento, especialmente en los programas que no cuentan con sistemas centrados en el paciente. En tales situaciones, atender la toxicidad causada por la cicloserina es fundamental para obtener buenos resultados clínicos y evitar los eventos adversos graves.
Grupo C
El grupo C comprende tanto medicamentos propiamente contra la TB como reposicionados (es decir, para una nueva indicación) que tienen una menor prioridad que los de los grupos A y B, ya sea porque son menos eficaces (etambutol, delamanid, pirazinamida, etionamida o protionamida, y ácido paraaminosalicílico) o porque son más tóxicos y su administración por vía parenteral es engorrosa (imipenem-cilastatina, meropenem, amikacina y estreptomicina). Estos medicamentos suelen incluirse en un esquema alargado si este no puede configurarse únicamente con fármacos de los grupos A y B.
Etambutol
El etambutol es un medicamento contra la TB que se utiliza para el tratamiento de la TB farmacosensible (TB-DS) y puede agregarse a los esquemas alargados contra la TB-MDR. En las dosis recomendadas, tiene un perfil de seguridad favorable. Debido a las dificultades para interpretar las pruebas de sensibilidad, solo debe considerarse el etambutol cuando se cumplan otros criterios de probabilidad de eficacia (por ejemplo, la evidencia a nivel poblacional de una baja prevalencia de resistencia en las cepas circulantes de TB-RR/MDR y que el paciente no tenga antecedentes de uso de etambutol, a partir de una anamnesis clínica fiable).
Delamanid
Sobre la base de la evidencia actual respecto a su eficacia y seguridad, se recomienda el uso de delamanid como un fármaco del grupo C (1). El delamanid tiene una potente actividad bactericida in vitro y una posible actividad esterilizante. Se cree que los derivados nitroimidazooxazólicos generan especies reactivas de nitrógeno, entre ellas el óxido de nitrógeno, que producen toxicidad celular en los estados metabólicos de baja intensidad. No hay restricción de edad para el uso del delamanid. En la actualidad hay formulaciones dispersables, que son preferibles a triturar y dispersar los comprimidos para adultos (47, 92). El delamanid se une firmemente a las proteínas plasmáticas, por lo que tiene una baja penetración en el sistema nervioso central. Sin embargo, los estudios en seres humanos y animales con TB del sistema nervioso central parecen indicar que el delamanid podría ser útil cuando no hay otras opciones (93).
El examen reciente de los datos para las directrices de la OMS (1) indicó que no hay otros motivos de preocupación respecto a la seguridad del uso simultáneo de delamanid con bedaquilina. Sus efectos combinados sobre el intervalo QT, en comparación con la bedaquilina o el delamanid solos, se evaluaron en un ensayo comparativo aleatorizado de 75 pacientes con más de 3000 electrocardiogramas (78). Los estudios realizados entre el 2020 y el 2022 no indicaron una mayor toxicidad con el uso de delamanid durante más de 6 meses. En cambio, mostraron la seguridad del uso concomitante de delamanid con bedaquilina, al tiempo que aumentaban las tasas de supervivencia de pacientes con pocas opciones terapéuticas (67, 81).
Los datos en animales no muestran evidencia de efectos teratógenos. Aunque las series de casos de embarazadas que recibieron delamanid son pequeñas, sus hijos tuvieron excelentes resultados al nacimiento, lo que indica que no se debe negar el acceso al delamanid a las embarazadas que lo necesiten. Se le puede considerar para el tratamiento de la TB-DR en las embarazadas con pocas opciones terapéuticas (50).
Pirazinamida
La pirazinamida se ha agregado habitualmente a los esquemas para la TB-MDR, salvo cuando hay una contraindicación clínica razonable para su uso (por ejemplo, hepatotoxicidad), algún otro evento adverso grave o farmacorresistencia. Sin embargo, no se cuenta con una prueba fiable de sensibilidad a la pirazinamida; por tal razón, se ha utilizado a menudo sin pruebas de sensibilidad a fármacos o a pesar de la resistencia demostrada. En cuanto a los esquemas alargados, solo se recomienda incluir la pirazinamida cuando los resultados de las pruebas confirmen la sensibilidad, y entonces se cuenta como un fármaco eficaz; en cualquier otro caso, si se incluye la pirazinamida en el esquema, no se cuenta como uno de los cuatro fármacos eficaces (94, 95). Hay sinergias entre la pirazinamida y otros fármacos como la bedaquilina, por medio de mecanismos de acción complejos que tienen efecto en las bacterias latentes.
Imipenem-cilastatina y meropenem
La combinación de imipenem-cilastatina (que no debe utilizarse en menores de 15 años) y el meropenem son los únicos carbapenémicos que tienen una función establecida en los esquemas contra la TB-MDR. Se administran por vía intravenosa, un inconveniente importante que limita su empleo más generalizado fuera de los hospitales, en especial en los entornos de bajos recursos (96-100). La administración intravenosa diaria no suele ser factible, a menos que se implante quirúrgicamente una vía central de acceso subcutáneo, o que se inserte por vía periférica un catéter venoso central. Se ha demostrado que el meropenem con clavulanato, como parte de los esquemas para pacientes con TB-MDR y TB-XDR (que por lo general también contienen linezolid), contribuye a una mejor conversión de los cultivos y una mayor supervivencia (101-103). El ácido clavulánico (en combinación con amoxicilina) no es un medicamento contra la TB sino un fármaco auxiliar, que se toma por vía oral cada vez que se administra una dosis del carbapenémico, unos 30 minutos antes de la infusión intravenosa. Cuando se agrega a un esquema, el ácido clavulánico no se cuenta como uno de los medicamentos contra la TB y no debe utilizarse sin el carbapenémico.
Amikacina y estreptomicina
La amikacina y la estreptomicina son los únicos dos antibióticos aminoglucósidos que pueden emplearse cuando las opciones para configurar el esquema son limitadas. Según la evidencia examinada en el 2018, la amikacina y la estreptomicina se asociaron con tasas más bajas de fracaso del tratamiento o recaída y muerte cuando se usaron en personas con infección por cepas de M. tuberculosis sensibles a ellas. Sin embargo, estos fármacos comparten las desventajas y las graves toxicidades (ototoxicidad y nefrotoxicidad) de otros medicamentos inyectables que ya no se recomiendan, la kanamicina y la capreomicina. Dada la elevada frecuencia de resistencia a la estreptomicina en los pacientes con TB-RR/MDR en muchos entornos, así como su amplio uso durante años como parte de los esquemas de primera línea contra la TB más antiguos en muchos países, es poco probable que la estreptomicina se use mucho en los esquemas terapéuticos para la TB-MDR.
Etionamida y protionamida
Según la orientación de la OMS, la etionamida y la protionamida se consideran intercambiables. En las directrices unificadas de la OMS se hace una recomendación condicional contra su uso en los esquemas alargados para la TB-MDR, y se reservan para las situaciones en que no se puedan utilizar varios fármacos más eficaces (por ejemplo, bedaquilina, linezolid y clofazimina). Aparte de su bajo perfil bactericida, el uso de etionamida y protionamida se ve limitado por la mala tolerancia gastrointestinal, que puede llevar a una adhesión deficiente. Estos medicamentos no suelen recomendarse para las embarazadas debido a la mala tolerancia, a que ocasionan disminución de las concentraciones de hormona estimulante de la tiroides (que es fundamental para el desarrollo del feto) y a las preocupaciones generadas por sus efectos en los estudios sobre reproducción en animales.
Ácido paraaminosalicílico
El ácido paraaminosalicílico (PAS) puede considerarse como el último recurso para el tratamiento de la TB-RR/MDR. A menudo se tolera mal, y tiene una actividad bacteriostática modesta. En las directrices unificadas de la OMS se recomienda el uso de este fármaco únicamente para el tratamiento de los pacientes con TB-RR/MDR que siguen esquemas alargados si no se utilizan bedaquilina, linezolid, clofazimina o delamanid, o si no hay mejores opciones para configurar un esquema. No hay indicios de resistencia cruzada entre el ácido paraaminosalicílico y otros fármacos contra la TB (1). Su empleo es limitado debido a la mala tolerancia gastrointestinal.
Otros medicamentos
Algunos medicamentos que se recomendaban anteriormente como posibles componentes de los esquemas terapéuticos alargados para la TB-MDR no forman parte de los grupos A-C.
Isoniacida en dosis altas
La isoniacida en dosis altas no está incluida en los grupos A-C, dado lo esporádico de su utilización en los esquemas alargados para la población adulta. Se considera un medicamento relativamente seguro, como se demostró recientemente en la experiencia con su utilización en dosis de 10 mg/kg, en la que solo el 0,5% de 1006 pacientes de un estudio observacional multicéntrico sobre el esquema acortado para la TB-MDR presentaron neurotoxicidad de grado 3 o 4 (104). Otra evidencia indica que también puede ser útil en los esquemas alargados para la TB-MDR. En primer lugar, en la revisión sistemática y el metanálisis de los datos de pacientes individuales encargada por la OMS en el 2015 para describir los resultados del tratamiento en la población infantil con TB-MDR (que abarcaron a 975 niños y niñas de 18 países), el uso de isoniacida en dosis altas se asoció con un éxito del tratamiento en este grupo con TB-MDR confirmada (razón de probabilidades [odds ratio] ajustada [ORa], 5,9; intervalo de confianza [IC] del 95%, 1,7-20,5, p = 0,007) (105, 106). En segundo lugar, en un ensayo clínico aleatorizado, con doble enmascaramiento, comparativo con placebo, realizado en personas adultas con TB-MDR, los participantes que recibieron dosis altas de isoniacida (16-18 mg/kg) ( junto con kanamicina, levofloxacina, protionamida, cicloserina y ácido paraaminosalicílico) tuvieron una probabilidad significativamente mayor de presentar una conversión del cultivo al cabo de 6 meses de tratamiento que los que recibieron placebo o la dosis convencional de isoniacida (5 mg/ kg) (73,8% en comparación con 48,8% y 45,0%, respectivamente), y la mediana del tiempo hasta la conversión del cultivo se redujo significativamente en el grupo con isoniacida en dosis altas (3,4 meses en comparación con 6,6 y 6,4 meses, respectivamente) (107). En tercer lugar, en un estudio más reciente sobre la actividad bactericida temprana en pacientes con TB-MDR (en el cual la resistencia a la isoniacida se debía a mutaciones aisladas del promotor de inhA), se demostró que las dosis diarias de 10 a 15 mg/kg de isoniacida mostraban una actividad bactericida similar a la de la isoniacida en la dosis convencional (5 mg/kg) cuando se administraban a pacientes con TB farmacosensible (108). Es poco probable que las cepas con mutaciones aisladas de katG, o con mutaciones tanto de katG como de inhA, respondan incluso a las dosis altas de isoniacida, dado que las CIM de la isoniacida para esas cepas por lo regular son altas. A falta de información sobre los patrones de las mutaciones de resistencia a la isoniacida en un determinado paciente en lo individual, conocer la prevalencia de ambas mutaciones entre las cepas de TB-RR que circulan localmente (por ejemplo, a partir de la vigilancia de la farmacorresistencia en el entorno epidemiológico respectivo) también permite fundamentar las decisiones sobre qué esquemas terapéuticos serían los más apropiados.
 Reacción
Reacción